Lecture : Les anciennes unités
|
|
|
Système décimal |
|
Environnement du dossier
|
|
2°) les unités de masse dans le système métrique |
|
|
|
|
|
|
|
|
I ) Les trois états de la matière. (exemples) |
¥ |
|
¥ |
|
COURS
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Activité
découverte : Les objets qui nous entoure , les êtres vivants , l’air que nous
respirons , l’eau que nous buvons , les aliments que nous mangeons , les
pierres , les plantes , la Terre ;le Soleil ; la Lune et les
étoiles , sont composés de matière . Cette
matière se présente sous trois formes différentes , dit aussi « trois
états différents » : Solides , liquide et
gazeux . |
|
|
|
|
|
|
|
Les solides : |
|
|
|
|
|
|
|
On
peut les saisir . Ils ont leur forme propre. |
|
|
|
On en
trouve en poudre ou en grains ; ils s’écoulent et peuvent se mettre en
tas. |
|
|
|
|
|
|
|
Exemples de
solides : |
|
|
|
|
|
|
|
« durs » La pierre ; un panneau épais ; un crayon ; une
casserole ; une tablette de chocolat ; une bille ; un morceau
de sucre . |
|
|
|
|
|
|
|
« mous » Du
beurre ; de la pâte à modeler ; du chewing-
gum |
|
|
|
|
|
|
|
« élastiques » Un
élastique ;un pneu ; une gomme ; un
réglet métallique ; une règle . |
|
|
|
|
|
|
|
« ductiles » ( peut s’étirer en fil fin) L’or ; le cuivre |
|
|
|
|
|
|
|
En grain
ou poudre. Sucre
en poudre ; la farine ; le café en paquet ; le sable ; le
sel ; …… |
|
|
|
|
|
|
|
INFO sur les solides et les minerais : Il
existe quelques minerais à l’ état natif comme
l’or , l’argent , le platine et le cuivre . Les autres
minerais se trouvent sous forme d ‘ oxydes , de sulfures , de
carbonates . Ils subissent
d’abord une préparation mécanique : concassage et broyage
. Puis
les minerais sont débarrassés de leur
gangue , c’ est le traitement physique
du minerai : il y a décantation
et ou triage magnétique
.Le métal est ensuite mis sous forme d ’ oxyde
par voie chimique , et cet
oxyde est traité par électrolyse . |
|
|
|
|
|
|
|
Les liquides |
Voir
« EAU » |
|
|
On ne peut pas les saisir ; ils n’ont pas de forme propre Ils prennent la forme du récipient qui les contient et en occupe
d’abord le fond . La surface d’un
liquide est toujours horizontale . Les liquides peuvent
dissoudre certains solides ; ( sel ; sucre ;…..) Certains
liquides peuvent se mélanger . Ils sont
incompressibles. |
|
|
|
|
|
|
|
Exemples de liquides : |
|
|
|
« Transparents » « on
voit à travers » : l’eau ; l’éther ; l’alcool à 90° |
|
|
|
« translucides » On voit mal à travers , mais ils laissent
passer la lumière ; Le
vin blanc ; l’huile d’olive ou d’arachide ; le thé ;la limonade . |
|
|
|
« opaques » On
ne voit pas à travers ;ils ne laissent pas
passer la lumière : le café ;l’encre ; le vin rouge . |
|
|
|
|
|
|
|
INFO : L’essentiel sur l’eau : =L’eau
filtrée contient des « corps solides dissous » .
C’est un mélange homogène. Les corps solides dissous sont mis en évidence par
évaporation de l’eau . = Les eaux minérales contiennent des
substances solides dissoutes , certaines peuvent
être nécessaires à l’organisme . = L’eau filtrée contient aussi des gaz
dissous. =Une
eau naturelle peut
dissoudre 19 millilitres d’air par litre d’eau à 20° C . Le dioxygène
dissous permet la vie aquatique . =La
distillation permet d’obtenir un corps pur . =L’eau
distillée ne contient ni particules en suspensions ,
ni gaz ni solide dissous .Mais ,
comme l’air distillée reste au
contact de l’air ,elle dissous de l’air et ne reste pas pure. Pour obtenir de
l’eau pur ,
il faut travailler en l’absence d ‘air et dans des récipients en silice . =La
distillation qui permet de séparer les différents constituants d ’ un mélange
liquide homogène
est appelée « distillation fractionnée ». La
distillation des pétroles est une distillation fractionnée. |
|
|
|
|
|
|
|
Les gaz |
Voir :« air » |
|
|
On ne peut pas les saisir . Ils n’ont pas de
forme propre . Ils prennent la forme du récipient
qui les contient et en occupent toujours la totalité. Ils
sont expansibles et compressibles . |
|
|
|
|
|
|
|
Exemple de gaz : |
|
|
|
|
|
|
|
« odorants » Le
gaz naturel ; le parfum d’une fleur |
|
|
|
« sans
odeur » L’air |
|
|
|
« visible » Le
chlore |
|
|
|
« invisible » L’air ;
le gaz naturel ; le parfum |
|
|
|
|
|
|
|
INFO : L’essentiel sur
l’air : =L’air
est un mélange hétérogène
puisqu’il contient
notamment des poussières et des microbes . Par filtration ,
on obtient un mélange homogène constitué de : -
diazote : 78 , 084 . -
argon : 0 , 934 . -
dioxyde de carbone : 0,033 . -
néon :
0,0182 . -
hélium : 0 , 000 524 . -
méthane : 0 , 000 2 -
krypton : 0 , 000 114 -
dihydrogène : 0 , 000 05 -
oxyde
d ‘azote : 0, 000 05. -
Zénon :
0 , 000 01 . -
Ozone :
0 , 000 01.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
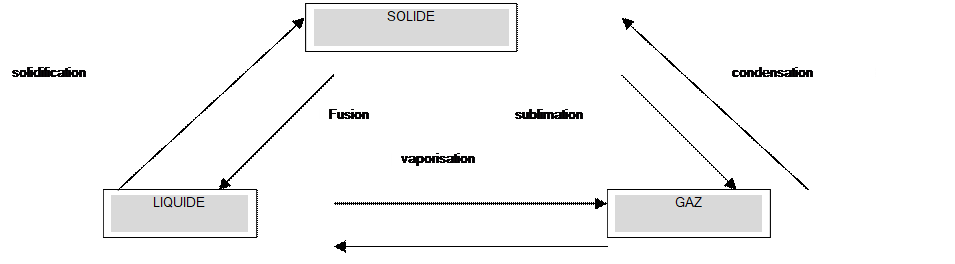
= Un
changement d ’ état est le passage d ’ un état de la matière à un autre état de la matière . =Les
différents changements d’état sont : |
|
|
|
|
|
|
|
|
|
|
|
Schéma à
connaître : |
|
|
|
|
|
liquéfaction
|
|
=Lors d’un passage de l’état liquide à l’ état solide ,
la température d’un corps pur demeure constante : c’est la température
de solidification . = Lors d’un passage de l’état liquide à l’ état solide ,
la température d’un corps pur demeure constante : c’est la température
de fusion . =Sous la même pression , la solidification et la fusion
d’un corps pur se font à la même
température . Cette température est caractéristique d’un corps pur donné . =Un corps pur est caractérisé par quelques constantes physiques : la
température de fusion ( notée : qf ) ; la température d’ ébullition (
notée qe ) =Les constantes physiques de l’eau
pure sont : qf = 0°
C ;
qe = 100° C ( sous pression
normale , c’est à dire 1 bar ) . · Si
un liquide ne se solidifie pas à température constante sous une pression donnée ,
ce liquide n’est pas un corps pur , c’est un mélange ( en métallurgie on dit
« alliage ») |
|
|
Corps pur |
Fer |
Cuivre |
Argent |
Zinc |
Plomb |
Etain |
Eau |
Alcool |
|
Température de fusion. ( °C) |
1535 |
1083 |
960 |
420 |
327 |
232 |
0 |
- 139 |
|
Température
d ’ ébullition ( °C) |
2750 |
2336 |
2000 |
907 |
1740 |
2270 |
100 |
79 |