Pré requis:
|
Domaine : |
|
|
Etude
d’un liquide et d’un gaz : L’eau ; l’air ; ….. |
|
ENVIRONNEMENT
du dossier:
AVANT :
|
APRES :
|
Complément
d’Info :
|
||
|
|
|
|
|
|
TITRE : l’ ATOME : Nomenclature
|
CHAPITRES : |
|
|
1.
Eléments
|
|
|
|
|
|
3.
Atome |
|
|
4.
Identification
d’un atome (modèle de Bohr) |
|
|
5. La mole d’atomes et masse
molaire atomique. |
|
|
|
|
|
|
Travaux ; devoirs
|
|
Corrigé
|
|||
|
|
Contrôle |
||||
|
Interdisciplinarités : (matière concernée) |
||||||||
|
F |
H |
Géo. |
Vie quotidienne et vie familiale |
Autres : |
Sciences et technique
|
Physique Chimie Electricité |
Statistique. |
|
|
ok |
|
|
|
ok |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l’ ATOME : Nomenclature
|
|
|
|
COURS
|
|
Préambule :
L’élément : Un
« élément » est un « corps».
Remarque : un élément peut avoir différents aspects ;
Exemple : l’élément fer est ce qui est commun au métal
fer et à tous ses composés .Il peut se trouver sous forme métallique ou sous
forme d’oxyde de fer (rouille). A l’issue de différentes réactions
chimiques sur le métal ou sur l’oxyde,
on constate que les éléments sont conservés.
Un élément chimique est un corps simple.
Un corps simple n’est constitué
que d’un seul élément ( exemple : métal
fer)
Un corps composé contient au moins deux éléments ;
( Exemple: l’oxyde de fer contient les éléments
oxygène et fer ; l’acier et la
fonte contiennent du carbone et du fer)
Nota : l’acier est obtenu par affinage de la fonte (pour cela on
brûle le carbone)
On recense et on connaît actuellement 109 éléments chimiques qui
possèdent tous un nom et un symbole.
Identification des éléments :
|
Un symbole : ce symbole commence toujours par une majuscule,
généralement on donne la première lettre de son nom français ou latin . |
Nom de l’élément |
symbole |
|
Aluminium |
Al |
|
|
Argent |
Ag |
|
|
Azote (nitrogène) |
N |
|
|
Fer |
Fe |
|
|
Hydrogène |
H |
|
|
Or (aurum) |
Au |
|
|
Oxygène |
O |
|
|
Plomb |
Pb |
|
|
Sodium (natrium) |
Na |
|
|
Soufre |
S |
Lorsque plusieurs noms commencent
par la même lettre , on ajoute une minuscule ,
par exemple C pour le carbone , Cl pour
le chlore , Ca pour le calcium et Co pour le cobalt.
Exemples de représentation d’un atome :
|
Représentation d’un atome de carbone ( C) |
Représentation d’un atome de chlore ( Cl) |
Représentation d’un atome de calcium ( Ca) |
|
|
|
|
|
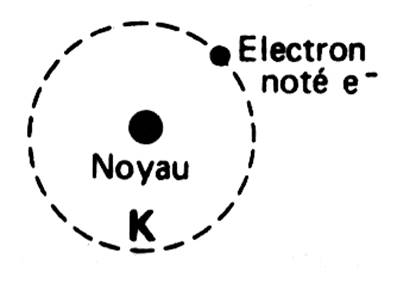
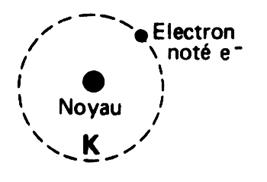
Un atome est constitué d’un noyau autour duquel gravitent 1 ou
plusieurs électrons. ( la
première couche d’électrons porte la lettre « K ».) |
La charge électrique d’un électron est égale (charge négative), en
valeur absolue, à la charge électrique du proton ( charge
positive) .Un atome est électriquement neutre : il y a donc , dans un
atome , autant d’électrons que de protons. |
|
|
|
Les chimistes ont montré que les particules constituant la matière sont
toutes formées à partir d’atomes.
(on verra par suite que les
atomes vont s’organiser pour former des
structures moléculaires ou non moléculaires : ce qui nous permettra
de définir ce qu’est un état gazeux , solides , ou
liquides)
La structure de l’atome : L’atome est
constitué de deux parties :
|
1°) le noyau :
il contient des neutrons et des protons . Les neutrons sont électriquement neutres. Les protons sont chargés
positivement |
Le
noyau est très petit par rapport à l’atome. L’atome
et le noyau sont sensiblement sphériques. Exemple de l’atome d’hydrogène : |
|
« électriquement »
on dira que le noyau de l’atome est chargé positivement. |
|
2°) le nuage ou cortège électronique.
|
Ce cortège d’électrons est
chargés négativement , ces électrons sont en mouvement autour du noyau . Tous les électrons sont retenus par le noyau, mais ils ne sont pas
retenus de la même manière, et il faut plus ou moins d’énergie pour les séparer d’où un classement de ces
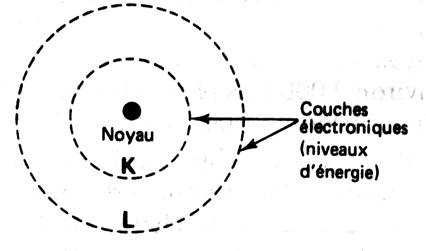
électrons par niveaux d’énergie. Chaque niveau d’énergie est caractérisé par une lettre
« K » ; « L » : « M » ; …. Ces couches d’électrons se remplissent suivant une règle
, qui sera exposée plus loin. |
|
|
L’électron est chargé d’une quantité d’électricité négative
, dont la valeur absolue est égale à celle du proton , donc e-
( pour cette raison , l’électron est aussi appelé le négaton). Or nous savons
que deux particules chargées d’électricité de signe contraire sont soumises à
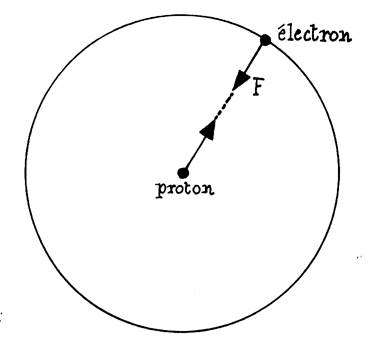
une force d’attraction mutuelle. A cause de la différence de masse, on dit
pratiquement que l’électron est attiré par le noyau(bien
qu’en réalité le noyau soit attiré avec une force égale par l’électron).Sous
l’effet de cette force dirigée vers le centre ( appelée une force centripète)
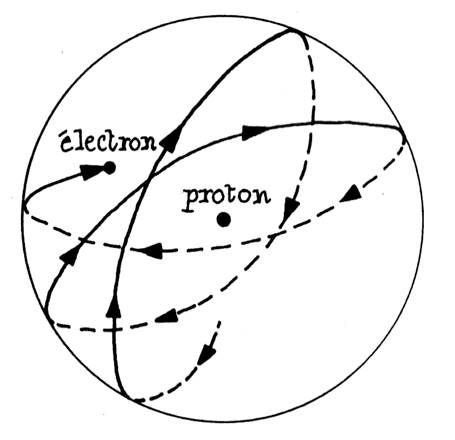
l’électron est animé d’un mouvement de rotation. Ce mouvement n’est pas
rigoureusement circulaire, et il n’est pas plan. En première approximation,
l’électron se déplace sur une sphère dont le rayon est celui de l’atome. |
|
Vocabulaire : les protons , neutrons , électrons sont appelés
« particules »
Caractéristiques de ces particules :
|
|
Masse
en kg |
Charge
électrique ( « C » ) lire : coulomb |
Rayon
(m) |
|
Proton |
1,67.
10-27 |
+
1,6.10-19 |
1,2
. 10 -15 |
|
électron |
9,1
. 10 - 31 |
- 1,6.10-19 |
2,8.
10 -15 |
|
Neutron |
1,67.
10-27 |
0 |
|
Protons et neutrons ont à peu prés la même masse.
Comparaison de ces caractéristiques :
-
comparons les masses du proton (1,67. 10-27) et du neutron
(1,67. 10-27) étant très supérieures à celle de l’électron (9,1 . 10 - 31)
, la masse de l’atome est très voisine de celle du noyau. (
parce ce que l’on peut remarquer que
la masse d’un électron est environ
2 000 fois plus petite que celle d’un proton ou d’un neutron)
-
La charge électrique des protons et celles des électrons sont égales en
valeur absolue . (on dit aussi : la charge d’un
proton est égale et opposée à celle d’un électron)
-
Le nombre de protons étant égal au nombre d’électrons ,
donc l’atome est électriquement neutre
.
Un atome est symbolisé par l’écriture suivante :
 Convention d’écriture :
Convention d’écriture : ![]() Atome. ; Exemple : 1123
Na
Atome. ; Exemple : 1123
Na
Pour identifier un atome on cite son nom par une lettre majuscule ;
précédé par deux nombres situés : un nombre en haut à gauche (en
exposant) et un nombre en bas à
gauche de la lettre (indice) .
Le nombre en haut
à gauche ( 23
) représente la somme du nombre de
protons et de neutrons qu’il contient
.Ce nombre est appelé « nombre de masse » on le désigne par la lettre
majuscule « A ». On dit aussi
que le nombre de nucléons ( protons et neutrons) que
comporte un noyau est noté « A » .
Le nombre en bas à
gauche (11) représente le nombre de protons que contient
le noyau de l’atome. Ce nombre est appelé « numéro atomique » ,on le désigne par la lettre « Z » . Il
caractérise l’élément chimique. ( 11 représente aussi
le nombre d’électrons)
►Isotope : deux noyaux ayant même nombre de charge
« Z » et des nombres de masse « A » différents sont des
isotopes.
Nota :
Puisque
le nombre de protons est égal au nombre d’électrons.
On dira que :
Le
nombre de proton étant égal au nombre d’électron , on peut donc dire que le numéro
atomique correspond au nombre d’électrons qui constitue le cortège (nuage )
électronique qui accompagne le noyau de l’atome .
Exemple :on donne l’écriture suivante :
1123 Na (qui symbolise l’atome de Sodium (natrium))
Na : désigne l’élément atome de sodium .
« 11 » : On sait que l’atome de Na a 11
électrons qui gravitent sur la périphérie du noyau .
« 23 » :
représente la somme de protons ( p ) et de neutrons ( n ) ; ainsi 23 = p + n ; puisque « p =
11 » ; 23 = p + n devient 23 =
11 + n ; on en déduit par calcul que n = 23 –11 soit n = 12 .
Conclusion : l’atome de
sodium a 11 électrons en périphérie ; son noyau possède 11 protons et 12 neutrons.
Autres exemples :
|
|
|
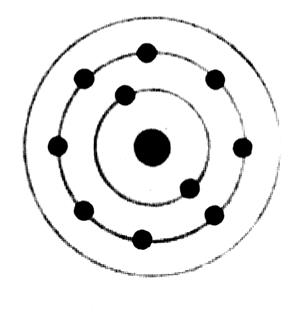
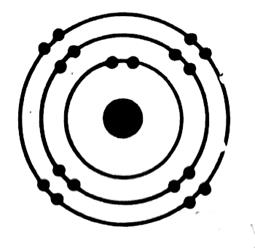
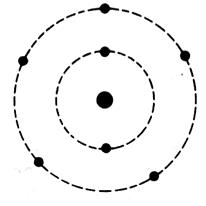
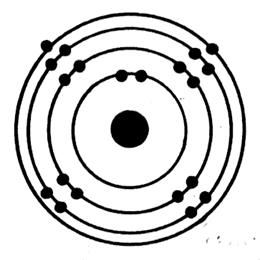
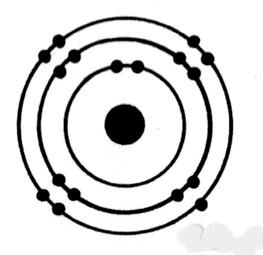
Modèle de Bohr (Bohr Niels 1885
- 1962) Physicien danois. |
|
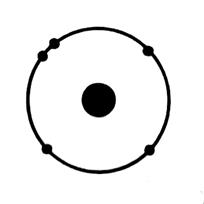
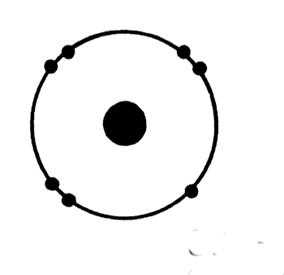
L’atome d’hydrogène possède un électron et un proton, le symbole de
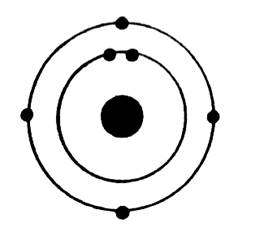
l’élément « Hydrogène » est « H » le symbole de l’atome d’hydrogène est La couche K = 1e - |
|
|
|
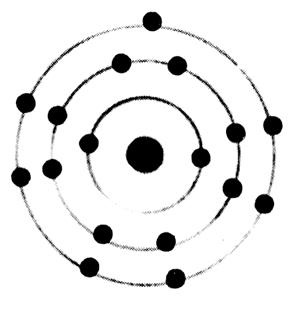
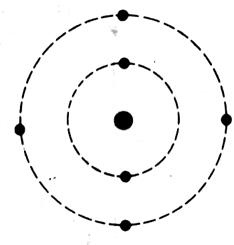
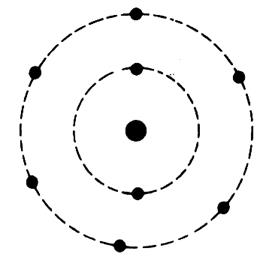
L’ atome
d’oxygène est constitué de huit électrons , huit protons , huit neutrons, le
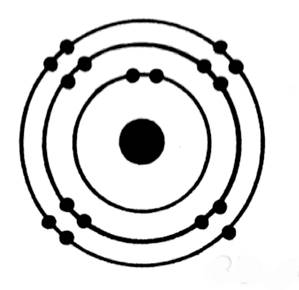
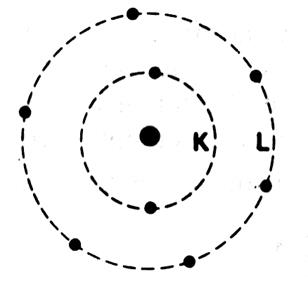
symbole est « O » Le symbole de l’atome est : La couche K = 2e - La couche L = 6e - |
|
|
|
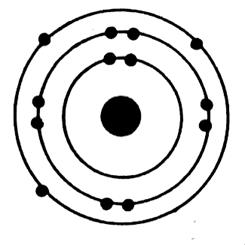
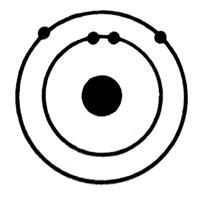
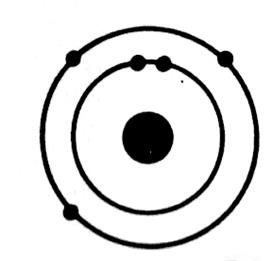
L’ atome de
carbone est constitué de six électrons
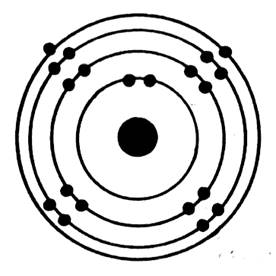
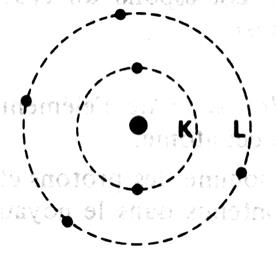
, six protons , six neutrons, le symbole est « C » Le symbole de l’atome est : La couche K = 2e - La couche L = 4e - |
|
|
Remarquez que la couche K contient au maximum 2 électrons : on dit
qu ‘elle est saturée à 2 électrons.
La couche « L » sera
saturée avec 8 électrons . (elle ne peut pas contenir
plus de 8 électrons) .
|
|
La mole d’atomes |
Exemple de calcul : On veut rechercher le nombre d’atomes contenus dans
Données : à l’échelle
microscopique, il y a dans un atome de fer : 28 électrons ; 28
protons ; 28 neutrons.
1°) Calcul : de la
masse d’un atome de fer ( = masse des protons + masse des
neutrons) ; on néglige la masse des électrons.
La masse de l’atome de fer est de :
( 28 ´ 1,67 ´ 10 -27
) + ( 28 ´ 1,67 ´ 10 -27
) = 93,52 ´ 10 -27 kg
2°) Nombre d’atomes contenus dans les
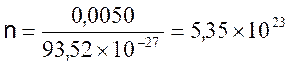
c’est un très grand nombre………..
Pour travailler , à l’échelle humaine ( ou
macroscopique), nous définirons une nouvelle grandeur : la mole d’atomes.
Nombre d’ Avogadro
(Avogadro Amédée 1776 - 1856) chimiste italien): Le nombre d’atomes contenus dans une
mole d’atomes s’appelle le « nombre
d’ Avogadro » sa valeur est : 6,02 ´ 10 23
L’élément de référence qui a été
choisi par Avogadro est le carbone (par que c’est un élément rencontré très
souvent dans de nombreuses combinaisons chimiques) : ainsi on sait que
Ainsi dit - on : que cette masse de
Si nous reprenons l’écriture symbolique du carbone : ![]()
Nous remarquerons que :
1°) le nombre « 12 » représente le nombre de masse de l’élément
carbone à l’échelle microscopique et également il représente la
« masse molaire atomique ».
2°) L’écriture symbolique ![]() représente aussi la
mole d’atomes de carbone soit 6,02 ´ 10 23
atomes de carbone.
représente aussi la
mole d’atomes de carbone soit 6,02 ´ 10 23
atomes de carbone.
Aussi nous appliquerons :
► l’ atome d’hydrogène ![]() a pour masse
molaire atomique
a pour masse
molaire atomique
► l’atome d’oxygène ![]() a pour masse molaire atomique
a pour masse molaire atomique
►l’atome de carbone ![]() a pour masse
molaire atomique
a pour masse
molaire atomique
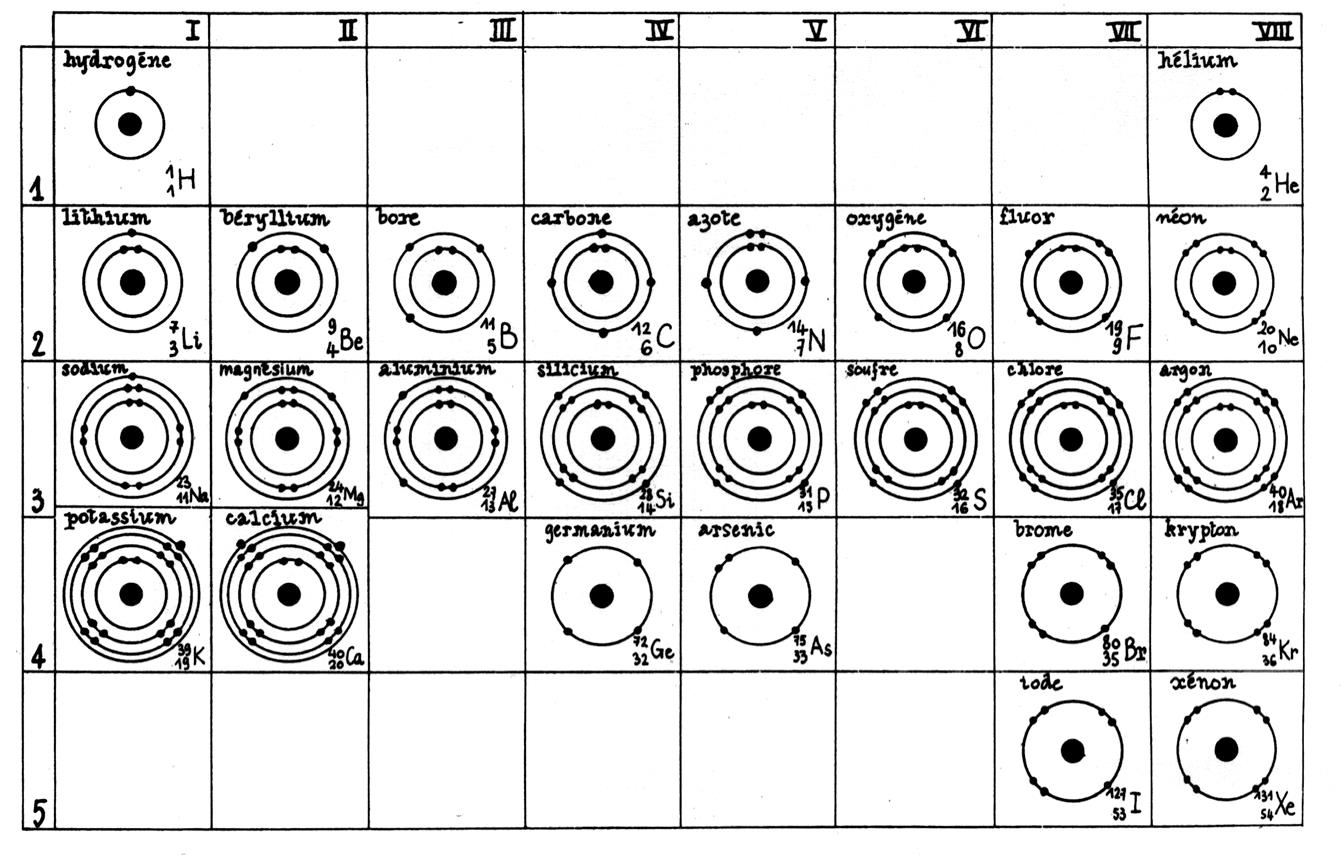
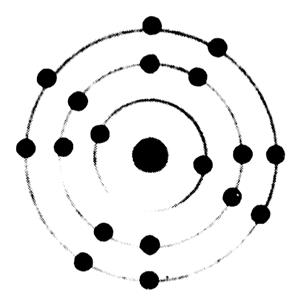
Extrait du tableau des classifications des éléments
chimiques (représenté avec le modèle de Bohr ) :
Premières analyses : le nombre en bas à gauche est appelé « nombre
atomique »
Nous constatons que les éléments peuvent être classés par ordre de
nombre atomique croissant.
Remarquons qu’au remplissage d’une couche électronique ( niveau d’énergie) correspond à une « période »
(ligne)
|
|
On admettra :
Les éléments de la première colonne ( lithium,
le sodium et le potassium) ont la même réaction chimique ( apparition d’une
flamme en contact avec l’eau)
Les éléments appartenant à la dernière colonne sont appelés « gaz
rares » ou « gaz inertes » . Ils
sont très peu réactifs chimiquement. La couche électronique externe est
saturée. La présence de huit électrons
(deux pour la première couche, sur la couche externe) explique la faible
réactivité chimique.
Pour les éléments des autres colonnes (compris entre la première et la
dernière colonne) , c’est au cours d’une réaction
chimique qu’ils vont évoluer vers la stabilité en saturant leur couche électronique externe.
|
|
IONISATION et IONS |
Les propriétés chimiques dépendent des électrons : c’est en effet
par les orbites externes (couche externe ou dernier niveau d’énergie)de
leurs atomes que les éléments vont se lier.
En règle générale, les atomes tendent vers une configuration où l‘ orbite externe comporte 8 électrons. Cas
particulier : seule la première orbite, celle de l’hydrogène,tend à perdre ou à gagner un électron. Cette
première orbite, en gagnant un électron, est saturée avec deux électrons.
Pour acquérir cette
structure (chercher à saturer la dernière couche à 8 électrons) certains
éléments voient leurs atomes perdrent ou d’autres
atomes gagner des électrons.
Ainsi :
La liaison entre deux ou des atomes se fait
« électroniquement » . (
électron – niquement : par liaison
électrique dite « électronique » )
Les atomes pour s’ assembler s’échangent des électrons ; on dit en
« prenant » ou en « donnant ou cédant » des électrons .
En prenant ou en
cédant des électrons , les atomes se transforment en
particules chargées ou négativement ou positivement .Ces atomes sont appelés « ion » ( les ions)
On appelle : « ionisation »
la perte ou le gain d’électrons par des éléments.
Les
Ions positifs ou
« Cation » :
Lorsque des atomes perdent des électrons ,
ils ne sont plus électriquement neutre, mais ils deviennent
porteurs d’une ou plusieurs charges positives excédentaires. On les appelle « ions positifs » ou
« cations »
, et les éléments correspondants sont dits
« électropositifs ».
Exemple : l’atome d’hydrogène tend à perdre
son électron et à se réduire à un proton. Le sodium a également tendance à
perdre un électron : il lui en reste alors 10 tandis qu’il conserve 11
protons.
Lorsqu’un atome ou un groupe d’atomes « cède » ou « perd » un ou plusieurs
électrons à un autre corps , il se transforme en
un ion chargé positivement , appelé
« cation »
Dans l’écriture , les ions (ou plutôt les ions
-grammes : 1 ion- gramme = 6,02 ´ 1023 ;
6,02 ´ 1023 est le nombre d’Avogadro) sont représenté, pour
l’hydrogène par H+ et
le sodium par Na+
L’ionisation du calcium et du magnésium , dont
les atomes perdent deux électrons, aboutit à : Ca++ et Mg++ ou Ca2+ et Mg2+ , parce qu’ils ont perdu deux électrons de
la couche externe.
(Autres exemples : K+ ( « K »
perd 1 électron) ; Cu2+ ( « Cu » perd 2 électrons) ; Al3+ ( « Al » perd 3 électrons) ; …)
|
Exemple :
Atome de sodium : |
Ion
sodium ( l’atome à perdu
un électron) |
|
|
|
Les
IONS négatifs ou
« Anions » :
En vertu de la même règle générale, les atomes de certains corps ont
tendance à gagner un électron, comme le chlore, par exemple, dont l’atome
comporte 7 électrons externes. L’ion gramme s’écrit alors : Cl -
Le soufre et l’oxygène , en gagnant deux
électrons , sont représentés par : S-- et O-- ou par S2- et O2-
Il s’agit ici d’ions négatifs, correspondant à des éléments
électronégatifs.
Lorsqu’ un atome ou groupe d’atomes « prend » ou « gagne » un ou plusieurs
électrons à un corps , il se transforme en un ion
chargé négativement , appelé
« anion ».
Remarque : En principe :
► l’hydrogène et les métaux qui possèdent 4 électrons au maximum
sur la couche externe sont électropositifs ( ils
perdent des électrons)
►Les métalloïdes qui possèdent au moins 4 électrons sur la couche
externe sont surtout électronégatifs.
Exemple :
|
Ion chlore ( l’atome
gagne un électron) |
atome
chlore |
|
|
Les IONS monoatomiques et poly-atomiques
(exemples :
Cl- ; SO4 2 ; NO3- , ….)
Un ion monoatomique est constitué d’un seul atome .
Les ions monoatomiques se différencient nettement par leur orbite
externe des atomes correspondants et seront caractérisés par des propriétés
spécifiques particulières et différentes des propriétés des atomes.
Un ion poly-atomique est constitué de plusieurs atomes.
Les groupements d’atomes qui en perdant leur neutralité électrique
deviennent porteurs de charges positives ou négatives seront des ions poly
atomiques.
Remarques sur les gaz
rares : le néon et l’argon figurant dans le tableau (dernière colonne : la
colonne la plus à droite) portent 8 électrons sur leurs orbites externes ;
l’hélium en porte 2 sur sa seule orbite ( saturée à 2
électrons). L’ionisation de ces éléments semblerait impossible ; elle est
en fait, très difficile.
Remarque sur la stabilité du noyau : l’ionisation affecte
uniquement les orbites ou couches électroniques ,
notamment l’orbite externe des atomes. Par contre les noyaux atomiques
jouissent d’une stabilité remarquable. Il existe cependant des éléments dont
les noyaux atomiques ont un comportement différent de celui des éléments habituels , cela concerne certains minerais d’uranium.
Cela a été montré en 1896 par Henry Becquerel
, puis ensuite en 1898 ,par les
époux Marie et Pierre Curie.
Travaux auto formatif N°1
I) CONTROLE:
1°) qu’appelle t – on
« élément » ?
2°) qu’appelle – t- on « élément
chimique » ?
3°)Compléter la phrase : Un corps
simple n’est constitué ……………………………
4°)Compléter la phrase : Un corps composé contient ……………………………….
5°) Combien recense t – on d’éléments
chimiques ?
6°) Identification des éléments :
compléter le tableau
|
ce symbole
commence toujours par une majuscule, généralement on donne la première lettre
de son nom français ou latin. |
Nom de l’élément |
Symbole
( ?) |
|
Aluminium |
|
|
|
Argent |
|
|
|
Azote
(nitrogène) |
|
|
|
Fer |
|
|
|
Hydrogène |
|
|
|
Or (aurum) |
|
|
|
Oxygène |
|
|
|
Plomb |
|
|
|
Sodium (natrium) |
|
|
|
Soufre |
|
7°) L’
atome :
Questions série
1 : sur La structure de
l’atome :
a) Nommer les deux parties d’un
atome :
b) Que contient le noyau ?
c) Comment est chargé électriquement le
noyau ? électriquement ,le noyau
est …………………..
d) Que contient le nuage ou
cortège électronique et autour de quoi tourne –t –il . ?
e) Comment est chargé ce cortège d’électrons ?
f) Comment nomme t – on aussi: les
protons, neutrons, électrons ? ………………………..
g) Quels sont les caractéristiques principales d’un
atome ? (concernant la masse et
électrique)
h ) Comment identifie
t-on un atome ? (donner un
exemple)
On donne cette convention d’écriture : ![]() Atome.
Atome.
-
Que désigne la lettre « A » ?
-
Que désigne la lettre « Z »
Utiliser l’exemple pour compléter votre réponse : 1123 Na
K) Que peut-on dire sur le nombre de
protons et le nombre d’électrons ?.
L ) Indiquer par une croix dans le
tableau l’état électrique de la particule.
|
|
Chargé positivement |
Chargée négativement |
Neutre |
|
Proton |
|
|
|
|
Neutron |
|
|
|
|
Electron |
|
|
|
|
Noyau |
|
|
|
|
Atome |
|
|
|
M ) Choisir la bonne réponse Lbarrer un mot.
-
le numéro atomique d’un élément est égal à son nombre de Charge /
masse. C’est aussi le nombre de protons / neutrons de l’atome .
-
Les masses d’un proton et d’un neutron sont à peu prés
les mêmes / très différentes . La masse d’un électron est très inférieure
/ supérieure à celle d’un proton.
-
Deux isotopes ont / n’ont pas le
même de protons , et ils n’ont / n’ont pas le même nombre de neutrons.
8°) Les IONS
a) Comment s’opère
la liaison entre des atomes ? :
b) Compléter la
phrase suivante :
Les atomes
pour s’assembler s’échangent des ………….. ; on dit en
« ……… » ou en « …………… » des électrons .
c) Comment appelle t –on un atome
qui cède ou prend (donne) des
électrons ?
d) Compléter les phrases suivantes :
les
atomes qui prennent des électrons se transforment en particules chargées ………….
les atomes qui cèdent des électrons se transforment en particules
chargées ……………...
e)
Qu’appelle – t- cation ? Donner des exemples.
f)
Qu’appelle – t - on
Anion ? Donner des exemples.
g) Qu’appelle –t-on un
ION monoatomique ?
h )
Qu’appelle –t-on un ION
poly-atomique ?
1°) Combien possède de neutrons
l’atome suivant 1123 Na
2°) On considère un atome de mercure (Z = 80 et A = 200) Déterminer les nombres de protons,
de neutrons et d’électrons.
3°) Pour l’ atome
d’aluminium 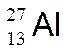 , quel est :
, quel est :
-
le nombre de charge ?
-
le nombre de masse ?
-
le nombre de protons ?
-
le nombre de neutrons ?
-
le nombre d’électrons ?
4°)le noyau d’un atome comporte 15
protons et 16 neutrons.
a)
quel est le nombre d’électrons de cet atome ?
b)
Quels sont ses nombres de charge et de masse ?
c)
Identifier l’atome à partir de son numéro atomique indiqué dans le
tableau ci - dessous :
|
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
Travaux auto
formatif N°2
I) CONTROLE:
La matière est formée de très petites particules appelées
« atomes » ; Décrire un atome et donner les noms de ses
principaux constituants :
L’élément carbone se note ![]()
Quel est le numéro atomique de l’atome de carbone ?
A quoi correspondent les deux nombres 6 et 12 ?
Dessiner schématiquement l’atome d’oxygène ![]()
Qu’est qu’une mole d’atomes ?
Dans la formule du sel ( chlorure de sodium) on a du Na+ et du Cl - . A quoi correspondent les écritures Na+ et Cl - ?
Comment s’exprime la masse molaire d’un atome ?
Qu’appelle - t on : masse molaire
atomique ?
Combien y a t - il d’atomes d’hydrogène dans 1 mole d’hydrogène. ?
Quelle est la masse molaire ?
de l’oxygène :
de l’hydrogène :
, du carbone :
, de l’azote :
, du chlore :
Que donne comme information le nombre d’ Avogadro ?
En vous aidant du tableau de classification identifier et nommer chaque élément :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
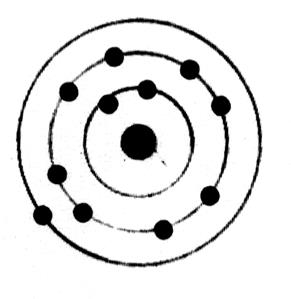
Répartition des électrons :
Les différentes couches sont
caractérisées par un nombre « n » appelé « nombre
quantique ». Chacune peut recevoir au maximum « 2n² »électrons.
1°) calculer les nombres d’électrons que peuvent recevoir la couche
« K » pour laquelle « n = 1 », la couche L pour
laquelle n = 2 et la couche M pour laquelle n= 3.
2°) Les électrons remplissant les couches successives dans l’ordre ci dessus ( n croissant) ,
déterminer leur répartition dans le cas de l’atome de soufre ![]()
|
Couche |
« n » |
Nombre d’électrons |
|
K |
1 |
2 ´ 1 ² = 2 |
|
L |
2 |
2 ´ 2 ² = 8 |
|
M |
3 |
2 ´ 3 ² = 18 |
Le nombre de charge est 16 . L’atome de soufre possède donc 16 protons. Puisqu’il est électriquement
neutre , il possède aussi 16 électrons.
Ces électrons se répartissent de la façon suivante : 2 dans la
couche K ; 8 dans la couche L et 6 dans la couche M , qui n’est pas
totalement remplie.
Exercices : comparer les nombres d’électrons dans la dernière
couche occupée par le fluor ( Z = 9 ) et
pour le chlore ( Z = 17).
II )EVALUATION:
1°) Trouver, à partir des symboles les nombres d’électrons, de protons
et de neutrons contenu dans l’ atome et en faire le modèle de Bohr:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Idem : |
Donner les mêmes informations que ci dessus
.Que constatez vous ? ( ne pas faire le modèle
de Bohr). |
|
|
|
|
|
|
|
|
Quelle est la structure électronique
des éléments suivants :?
|
Si ( Z = 14) |
|
|
|
S ( Z = 16) |
|
|
|
Ar ( Z = 18) |
|
|
|
Be ( Z = 4) |
|
|