|
DOC : formation individualisée soutien en ligne. |
DOC : livre Elève
.Cours interactifs - et travaux + corrigés. |
|
OBJECTIFS : savoir reconnaître les ions . |
I ) Pré requis:
|
Ÿ |
|
|
Ÿ |
II ) ENVIRONNEMENT du dossier :
|
Dossier précédent : |
Dossier suivant : |
|
Chapitres :
|
Ÿ |
|
|
Ÿ |
|
|
Ÿ |
|
|
|
IV) INFORMATIONS
« formation leçon » :
|
Travaux auto - formation. |
|
|
Corrigé des travaux auto - formation. |
||||
|
|
|
|
|||||
V ) DEVOIRS ( écrits):
|
Devoir diagnostique L tests. |
Ÿ |
|
Ÿ |
|
|
Devoir Formatif « Contrôle :
savoir » ; ( remédiation) |
Ÿ |
|
Ÿ |
|
|
Devoir sommatif
. |
Ÿ |
|
Devoir certificatif : ( remédiation ) |
Ÿ |
* remédiation : ces documents peuvent être réutilisés ( tout
ou partie) pour conclure une formation .
|
Leçon |
Titre |
|
N°2 |
CHAPITRES
|
Ÿ |
|
|
Ÿ |
|
|
Ÿ |
Information : Ecriture de
la formule des corps à structure ionique.
Lorsque
l’on doit écrire la formule de la molécule ou de la mole de molécule d’un corps
à structure ionique , nous pouvons utiliser
deux écritures :
Soit
l’écriture de la formule donnant uniquement la composition.
Soit l ’
écriture faisant apparaître les ions et leurs charges.
Exemples :
|
Exemples : |
Formule traduisant la composition. |
Ecriture ionique . |
|
Chlorure
de sodium |
Na Cl |
( Na + Cl - ) |
|
Chlorure
d ’ hydrogène en solution dans l’eau. ( acide
chlorhydrique) |
H Cl |
( H + Cl- ) |
|
Sulfate
de cuivre . (
traitement des vignes) |
Cu SO4 |
( Cu2+ , SO2-4 ) |
Nous avions
déjà vu que : Un atome peut perdre
ou gagner un ou plusieurs électrons afin d’être stable. Il devient un ion
positif ou un ion négatif.
|
|
|
Il existe dans les cristaux et les liquides , des
particules auxquelles on donne le nom de ions .
Imaginons différents atomes en présence , à une
température donnée : ils sont en agitation
constante , et ceci se traduit à leur échelle par un grand nombre de chocs entre eux . Au
cours d’un choc , l’un des atomes peut arracher
un ( ou plusieurs ) électrons à un atome voisin . Les deux atomes n’ont
plus leur nombre normal d ‘électrons ; on les appelle des ions simples .
Définition : Un ion
simple est un atome ( ou un groupe d’atomes ) ayant gagné ou perdu un ou
plusieurs électrons.
Il arrive qu’un ion ait une structure plus stable que
l’atome . Si après l ‘ échange d’ électrons , sa structure électronique est
devenue celle d’un gaz rare , elle est
particulièrement stable . Dans ce cas ,
l ‘ élément existera plutôt sous la forme ionique . Si , au contraire , l’ ion
est moins stable que l’atome , il ne
se conservera pas , et l’élément existera plutôt sous la forme atomique ou
moléculaire .
Remarque 1. Un ion simple
diffère de l’atome qui lui a donné naissance par le nombre d’électrons .
D’après ce que nous avons conclu de l’étude de la classification périodique ,
nous pouvons affirmer que les propriétés
d’un ion ne sont pas les mêmes que celle
de l’ atome qui lui a donné naissance .
Remarque 2 :
- Lorsqu
‘un atome qui à perdu un , deux ,
trois , ….électrons , l’ion formé
possède une , deux trois …charges positives »)
Les ions chargés
positivement sont appelés « cations »
- Lorsqu ‘ un atome qui a gagné un , deux , trois , ….électrons , l’ion formé possède une ,
deux trois …charges négatives »
Les ions
chargés négativement sont appelés « anions ».
Exemples :
Notation
d’un ion :
On ajoute au
symbole de l’atome , en haut et à droite , un indice (nombre) qui représente le
nombre de charges électriques de l’ion .Dans le cas où la charge est égale à 1
( +1 ou -1) , on ne note habituellement que le signe + ou - .
|
|
Anions ( ion négatif ) |
Cations .( ion positif) |
|
1 charge
|
H-
( ion hydrure ) ; OH-
( ion hydroxyde ) ; F- ( ion fluorure) ; Br -
(ion bromure) ; I - (ion iodure) ; NO3-
(ion nitrate ; HCO3- (ion hydrogénocarbonate ). |
H + (ion hydrogène) ; H3 O+
(ion hydronium) ; NH4+ ( ion ammonium ) ; Na +
( ion sodium ) ; K+ (ion potassium ) ; Cu+
(ion cuivre ) ; Ag+ (ion argent ) ; Cs+ (ion
césium) |
|
2
charges |
Ca 2+ (ion
calcium) ; Ba 2+ (ion
baryum ) ; Mn 2+ (ion manganèse ) ; Fe 2+ (ion
fer II) ; Co 2+ (ion cobalt II ) ; Ni 2+ (ion
nickel II) ; Cu 2+ (ion cuivre II ) ; Zn 2+ (ion
zinc ) ;Cd 2+ (ion cadmium ); Sn 2+ (ion étain
II) ; Pb 2+ (ion plomb);Mg2+ (ion magnésium ) |
; O 2 - (ion
oxyde) ; S 2 - (ion
sulfure) ; SO3 2 - (ion sulfite ) ;CO3 2
- (ion carbonate) ;SO4 2 - (ion sulfate
) ; Cr2O7
2 - (ion dichromate ) |
|
3
charges |
;
Al 3+ (ion aluminium)
; Au 3+ (ion or ) ; Cr
3+ (ion chrome
III ) ; Fe 3+ (ion fer III
);Co 3+ (ion
cobalt III ); Bi 3+ (ion bismuth
) |
PO4 3 - (ion phosphate ) ; N 3
- (ion nitrure ) |
|
4
charges |
;
Sn 4+ (ion étain IV
) ; Pt 4+ (ion platine
) |
; C 4 - (ion carbure ) |
Les ions
peuvent s’assembler entre eux pour former des « composés ioniques » .
Les liaisons
formées sont dites « ioniques » et résultent d’attirances
électrostatiques entre les ions de signes contraires et de répulsions entre les
ions de même signe .
Les
édifices ioniques sont électriquement neutres .
( Le sel de cuisine formé d’ions Na+ et Cl - comporte autant d’ions de chaque sorte .)
Aux
édifices ioniques ( assemblages atomiques)
sont associés des formules
« brutes » qui n’ont qu’une valeur statistique ( elles rendent seulement compte des quantités respectives de
chaque ion ).
Exemples : Nacl ( chlorure de sodium ) , Cu SO4 ( sulfure de cuivre ) ………
Lorsqu’un
composé ionique est fondu ou dissous dans l’eau
, les ions sont séparés et dispersés dans le liquide et le rendent
conducteur du courant électrique ( la solution porte le nom d’électrolyte ).
Les
solutions aqueuses ( aqueux = liquide eau ) ioniques sont
électrolysables .
Il y a
échange : les ions positifs ( cations) se dirigent vers la cathode ( électrode
négative) et les ions négatifs ( anions se dirigent vers l’anode ( électrode positive ).
|
|
|
L’eau peut dissoudre un grand nombre de composés
ioniques.
L’eau est
appelée « solvant » et le composé ionique dissous
« soluté » .
La
« solubilité » d’un corps dans l’eau est la masse maximale de ce
corps que l’on peut dissoudre dans un litre d’eau à une température donnée . (
voir « saturation »)
Exemple : A 19° C , la solubilité maximum du
chlorure de sodium dans l’eau est de 300 g / litre (ou 300 g . l -1 ) . La solubilité
maximum augmente , en généra , avec la température .
La mise en
solution d’un composé ionique provoque
la dispersion totale de ses ions .
Exemple : Mise en solution du chlorure de
sodium : Na Cl ® Na + + Cl -
La
concentration massique d’une solution représente la masse de soluté dissoute
dans un litre de solution . Elle s’exprime en gramme par litre ( g / l
ou g . l -1 )
La
concentration molaire d’une espèce chimique
( molécule , ion ) dans une solution est le nombre de moles de cette
espèce par litre de solution .
Elle
s’exprime en moles par litre ( mol . l -1 ou
mol / l )
Soit
« n » le nombre de moles de l’espèce
« A » dans le
volume « V » de solution . La
concentration de « A » qui se note [ A ] , est donnée par :
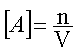
avec [ A
] : concentration en moles par litre ( mol . l -1 ou
mol / l )
n :
nombre de moles ( mol ) et V :
volume de solution en litre ( l )
exemple :
On dissous 5 grammes de chlorure de sodium Na cl
(sel) ( masse molaire 58,5 g / mol )
dans de l’eau et on obtient 50 ml de solution. Quelle est la concentration des
ions Na+ ?
Le chlorure de sodium se dissocie complètement dans
l’eau donc le nombre de moles d’ion Na+ est égal au nombre de moles
de NaCl.
Le nombre de moles de chlorure de sodium en solution
est n = 0,0855 mol ( 5 / 58,5 ) et la concentration en ions sodium dans la
solution est [ N a +] = 1,71
mol / l ( 0,0855 / 0, 050 )
|
|
|
Pour
caractériser des ions , on peut utiliser :
-
un test de flamme ( cas de l’ion sodium )
-
une précipitation d’un corps peu
soluble dans l’eau ( cas de l’ion chlorure) ;
-
la « redissolution »
d’un précipité ;
-
la formation d’un dégagement
gazeux .
Vocabulaire : ( à
connaître ) ( pré
requis : donner la définition de
« corps pur simples »
et corps pur composés » .)
Le vocabulaire utilisé en chimie pour désigner un produit
chimique peut permettre, lorsqu ‘ il s ‘ agit d’un corps composé :
-
de connaître la nature des éléments présents dans ce corps ,
-
de prévoir la formule chimique de ce corps .
réciproquement
la connaissance d ‘une formule permet , dans les cas simples , de donner
le nom chimique du produit .
· Un oxyde :
un oxyde est un corps pur composé qui contient l ‘ élément
« oxygène ». ( O )
exemples :
l
’ oxyde de cuivre a pour formule Cu O.
l’oxyde
magnésium a pour formule Mg O
· Un sulfure :
un sulfure est un corps pur composé qui
contient l ‘ élément « soufre ». ( S )
le sulfure
de fer a pour formule Fe S.
le sulfure
d ‘ hydrogène a pour formule H2
S
· Un chlorure : un chlorure
est un corps composé qui contient
l ‘ élément « chlore » ( Cl )
L e
chlorure d’argent a pour formule AgCl
Le
chlorure de fer a pour formule Fe Cl2
· Un hydroxyde est un corps pur composé qui
contient le groupement « oxygène -
hydrogène » ( OH )
l ’
Hydroxyde de fer a pour formule Fe ( OH)2
l ‘
hydroxyde de potassium a pour formule K
OH
· Un carbonate
est un corps pur composé qui contient le groupement « carbone et Oxygène » noté ( C O3
)
Le
carbonate de calcium a pour formule Ca C O3
Le
carbonate de zinc a pour formule : Zn C O3
· Un nitrate :
un nitrate est un corps pur composé qui
contient le groupement « azote et oxygène » noté N O3
le nitrate
d ’ argent a pour formule AgNO3 .
le nitrate
de plomb a pour formule Pb (NO3 )2
· Un sulfate :
un sulfate est un corps pur composé qui
contient le groupement « soufre et
oxygène » noté S O 4 .
Le sulfate
de cuivre a pour formule Cu S O 4.
Le sulfate
de zinc a pour formule Zn S O 4
Exemples d ‘ écritures ioniques :
Exemples de mise en présence d’ion :
|
Ion |
Réactif |
|
Chlorure :
Cl - |
Solution
de nitrate d’argent (AgNO3 ). Précipité
blanc ( chlorure d’argent AgCl ) qui se redissout dans une solution d’ammoniac. |
|
Sulfate :
SO42- |
Solution
de chlorure de baryum ( BaCl2 ) Précipité
blanc ( sulfate de baryum ,BaSO4) |
|
Sulfure :
S2- |
Solution
de nitrate de plomb ( PbNO3) Précipité noir (sulfure de plomb )
noté : PbS -
Solution de chlorure
d’hydrogène ( HCl) Production
d’un gaz nauséabond : le sulfure d’hydrogène ( H2S) |
|
Carbonate :
CO32- |
-
Solution de chlorure de
calcium CaCl2 Précipité blanc ( carbonate de calcium CaCO3
) -
Solution de chlorure d’ hydrogène (
HCl) Dégagement
de dioxyde de carbone ( CO2)
qui trouble l’eau de chaux . |
|
Nitrate :
NO-3 |
Cuivre (
Cu) et solution d’acide sulfurique ( H2 SO4 ) Dégagement de dioxyde d’azote ( NO2 ) qui est un gaz roux . |
|
Argent :Ag+ |
Solution
de chlorure de sodium ( Na Cl) Précipité blanc
( chlorure d’argent AgCl ) qui noircit à la lumière . |
|
Baryum :
Ba2+ |
Solution
contenant des ions sulfates ( SO42- ) Précipité blanc de sulfate de baryum ( BaSO4
) |
|
Plomb :
Pb2+ |
Solution
contenant des ions ( S2- ) Précipité noir (sulfure de plomb )
noté : PbS |
|
Aluminium :
Al3+ |
Solution
d’hydroxyde de sodium ( NaOH) Précipité blanc
gélatineux d’hydroxyde d’
aluminium ( Al (OH)3) qui
se redissout dans un excès de réactif . |
|
Zinc :
Zn2+ |
Solution
d’hydroxyde de sodium ( NaOH) Précipité blanc
d’hydroxyde de zinc ( Zn ( OH)2 ) qui se redissout dans un excès de réactif . |
|
Fer (
III) Fe3+ (couleur rouille) |
Solution
d’hydroxyde de sodium ( NaOH) Précipité rouille
d’hydroxyde de fer III ( Fe ( OH)3 ) |
|
Fer (
II) Fe2+ (couleur verdâtre) |
Solution
d’hydroxyde de sodium ( NaOH) Précipité verdâtre
d’hydroxyde de fer II ( Fe ( OH)2 ) |
|
Cuivre (
II ) / Cu2+ (couleur
bleue) |
Solution
d’hydroxyde de sodium ( NaOH) Précipité bleu
d’hydroxyde de cuivre II ( Cu( OH)2 ) |
|
i9 :i |
|
IMPORTANT : Tous les composés ioniques sont électriquement neutres ; la somme
des charges positives est égales à la somme des charges négatives.
Dans une
équation bilan un équilibre doit
s’opérer :
|
Leçon |
Titre |
|
N°2 |
TRAVAUX d ’ AUTO - FORMATION sur LES
IONS |
1°) Donner la
définition de corps pur simple et corps pur composé ?
2°) Donner
les deux formes d’écriture d’une formule
.
3°) Vocabulaire : qu’est qu ‘
un ? :
· Un oxyde :
un oxyde est un
corps pur composé qui contient l ‘ élément « oxygène ». ( O )
exemples :
· Un sulfure :
un sulfure est un corps pur composé qui contient l ‘
élément « soufre ». ( S )
· Un chlorure : un chlorure est un
corps composé qui contient l ‘ élément
« chlore » ( Cl )
· Un hydroxyde est un corps pur composé qui contient le
groupement « oxygène -
hydrogène » ( OH )
· Un carbonate
est un corps pur
composé qui contient le groupement
« carbone et Oxygène » noté ( C O3 )
· Un nitrate :
un nitrate est un
corps pur composé qui contient le
groupement « azote et oxygène » noté N O3
· Un sulfate :
un sulfate est un corps pur composé qui contient le
groupement « soufre et
oxygène » noté S O 4 .
4°) donner un nom au formules suivantes :
Le
chlorure de fer a pour formule Fe Cl2 ; Le sulfate de cuivre a
pour formule Cu S O 4.
Le carbonate de zinc a pour formule : Zn C
O3 ; L e chlorure d’argent a pour
formule AgCl
le
sulfure de fer a pour formule Fe S.
l’oxyde
magnésium a pour formule Mg O
Le
sulfate de zinc a pour formule Zn S O 4 ; l ’ Hydroxyde de fer a
pour formule Fe ( OH)2 ; l ‘
hydroxyde de potassium a pour formule
K OH
l
’ oxyde de cuivre a pour formule Cu O.
le
nitrate d ’ argent a pour formule AgNO3 . Le
carbonate de calcium a pour formule Ca C O3
le
nitrate de plomb a pour formule Pb (NO3
)2
le
sulfure d ‘ hydrogène a pour formule H2 S
1-
Donner le nombre d’électrons des
atomes d’oxygène 168
O et de fluor 199 F . Donner le nombre d’électrons de l
‘ion O 2- et de l’ion F-
. Que peut - on constater ?
2-
Donner la répartition électronique
de :
L’ion oxygène O 2- , l ‘ion fluor F- , l ‘ion sodium Na+ ; l ‘ion de magnésium Mg2+
.
Que peut -
on constater ?
3-En
utilisant le tableau des principaux ions
, donner les formules des composés ioniques ci - dessous , puis écrire leur équation de
dissolution :
|
Chlorure
de potassium |
|
|
Chlorure
de magnésium |
|
|
Fluorure
de calcium |
|
|
Oxyde de
zinc |
|
|
Oxyde de
calcium |
|
|
Nitrate
de cuivre |
|
|
Carbonate
d’aluminium |
|
3-
Donner les noms des composés ioniques ci - dessous , puis écrire
leur équation de dissolution :
|
FeO |
|
|
ZnS |
|
|
BaO |
|
|
Mg ( OH ) 2 |
|
|
CsBr |
|
|
Zn SO4 |
|
|
AgCl |
|
|
Pb ( NO3 ) 2 |
|
|
AgI |
|
|
|
|
5-La solubilité du dibrome dans l’eau est de 32 g./
litre à 20° C.
Calculer la concentration du dibrome dans une solution
saturée .
6- On mélange m1
= 2g de chlorure de sodium et m 2 = 2g de chlorure de potassium dans
250 ml d’eau .
-
Ecrire les équations de
dissolution.
-
Quels sont les ions présents dans la solution ?
-
Calculer leur concentration
molaire .
7- On mélange m1
= 4g de chlorure de cuivre II et m 2
= 2g de chlorure d ‘aluminium dans 500 ml d’eau .
-
Ecrire les équations de
dissolution.
-
Quels sont les ions présents dans la solution ?
-
Calculer leur concentration
molaire .
8- On mélange v1
= 200 ml d’une solution de chlorure de
sodium de concentration c1
0,1 mol/l et v 2 = 300
ml d’une solution de sulfate de sodium
de concentration c2 =
0,2 mol/l
- Ecrire les
équations de dissolution.
-
Quels sont les ions présents dans la solution ?
-
Calculer leur concentration
molaire .
9- Une solution ionique
incolore S , donne les tests suivants :
-
premier test :
l’addition d’une solution de chlorure de sodium produit un
précipité blanc qui noirci à la lumière
.
-
deuxième test : le
chauffage de S , avec du cuivre métal et
de l’acide sulfurique , donne naissance à un gaz roux .
La solution S est - elle une solution de NaCl ? K2
SO4 ; K NO4 ?
AgNO3 ?