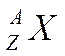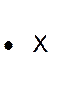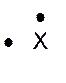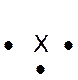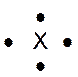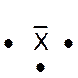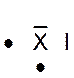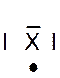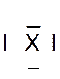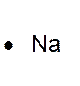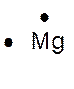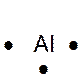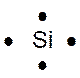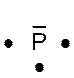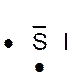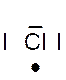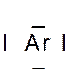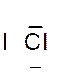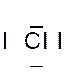Pré
requis:
|
|
Lecture le : |
|
|
|
|
|
|
ENVIRONNEMENT
du dossier:
AVANT :
|
APRES :
|
Complément
d’Info :
|
||||
|
|
||||||
|
|
|
|||||
|
|
TITRE : l’ATOME |
|
||||
|
|
|
|||||
|
|
|
|||||
|
|
|
|||||
|
|
|
|||||
|
|
Règle
de l’octet |
|
||||
|
|
|
|||||
|
|
V ) Les sept corps purs composés de base. |
|
||||
|
|
|
|
||||
Travaux ; devoirs
|
|
Corrigé
|
|||
|
|
Contrôle |
évaluation |
|||
|
|
|
|||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
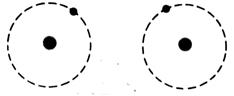
Introduction : tout
matière est faite d’atomes : Démocrite affirmait cela il y a déjà 2 500 ans ,
mais c ‘ est au XVIII e siècle que l’étude des réactions chimiques entre les corps simples imposa
cette notion. Les savants imaginèrent
alors la structure des atomes
et bâtirent des modèles.
Le premier modèle étant le
modèle planétaire ( c’est d ‘ abord
COOKES qui découvre l’électron) ; puis
RUTHERFORD imagine ,après expériences ( en complément de celles de Thomson et Millican
) , qu’un atome est composé d ‘un
noyau central électrisé positivement , dense ( presque toute la masse de
l’atome s’ y trouve concentrée ) et d’
électrons gravitant autour du noyau comme des planètes autour du soleil .
Ce modèle d’ atome planétaire très
simplifié est complété par la
spectrographie * qui a permis
de constater que les électrons en mouvement dans l’atome obéissent à
une certaine organisation . * la
spectrographie permet l’étude des spectres
lumineux obtenus en décomposant les
lumières complexes à l’aide d’un prisme (à travers d’un prisme les
radiations de longueurs d’onde
différentes sont déviées différemment (voir l’optique) Les recherches en physique
nucléaire sont loin d ’ être terminée et à l’heure actuelle l’atome apparaît comme un petit
univers dont le noyau est fort
complexe . Ce noyau est la source de nombreux phénomènes très important et son étude constitue la « physique
nucléaire ». |
|
||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
Dans la nature les corps sont
rarement à l’état pur ; nous les trouvons sous la forme de mélanges ou
de combinaisons , deux catégories de corps très
différentes. I -1 : Mélange :
un mélange présente une composition qui peut être modifiée à volonté (une eau
peut être plus ou moins salée) et ses propriétés dépendent étroitement de
celles de ses constituants. Ces derniers peuvent être séparés par des moyens
physiques simples : (décantation, centrifugation ; filtration,
évaporation, distillation, etc. . (Procédés
d’analyse immédiate) ; Un mélange est hétérogène si nous distinguons les substances qui le constituent. (Exemple : eau
boueuse) ; il est homogène dans le cas contraire (exemple : eau
salée). Par ailleurs, un mélange n ’ a pas de constantes physiques ; par exemple
sa température d’ ébullition varie au cours de l ’ ébullition . I - 2 : Combinaison : Dans une combinaison, la
proportion des constituants est invariable et il n’ y
a pas de relation entre les propriétés
de la combinaison et celles des constituants. Ceux - ci ne peuvent être séparés par les
procédés de l’analyse immédiate. Par
exemple, l’eau distillée est une combinaison
formée d’un volume d’oxygène et
de volume d ’ hydrogène .Une combinaison est
caractérisée par des constantes
physiques ( masse volumique , température d ’ ébullition ;
…)C’est un corps pur. Sa composition est établie par l’analyse et vérifiée
par la synthèse. Exemples de combinaisons : CaCO3 ; ZnCO3 ; AgCl ; FeCl2 FeS H2 S ; CuSO4 ;
ZnSO4 ;AgNO3 ;Pb(NO3)2 ; Fe (OH)2 ; KOH
; Cu O ; MgO ( nous verrons plus loin comment on peut
les classer ) 1-2 Corps purs. Une substance de laquelle aucun corps autre qu'elle- même ne peut-être extrait, est un corps pur. En général, un corps pur est caractérisé par des constantes physiques ( ex: les températures de changements d'états ), une
odeur, des propriétés sol vantes ….L'ensemble de ces propriétés le distingue
des autres corps purs et des mélanges. Exemples de corps purs : l'eau pure, le mercure, le dioxygène. Un corps pur, tel que l'eau, peut-être représenté par des particules
identiques, infiniment petites et indéformables que l'on appelle "molécule" Par des procédés chimiques, il
est possible de décomposer certains corps purs: ce sont les corps pur
composés. Exemple : l'eau pure se décompose en
hydrogène et oxygène ( H2 O) Les sept corps purs composés de base en chimie sont : l’Oxyde :;Sulfure ; Chlorure ;
Hydroxyde ; Carbonate ; Nitrate ; Sulfate Les autres corps purs qui ne sont pas décomposables en d'autres
corps qu'eux mêmes,
sont dits "corps purs simples" Exemples : le dihydrogène ; le dioxygène ;… |
|
||||||||||||||||||||||||
|
|
I - 3 : Elément |
|
||||||||||||||||||||||||
|
|
Une combinaison est souvent un corps pur composé ; elle peut
être décomposée en corps purs simples,
c’est à dire formés d ‘ une seule
sorte d’élément (un corps pur simple ne peut - être dissocié en d’autres corps purs). L’oxygène est un exemple d’élément ; il peut
être extrait de l’eau de l’alcool éthylique, du gaz oxygène. Actuellement,
environ une centaines d’éléments sont connus ;
ils sont répartis en quatre catégories : métaux ; métalloïdes,
transuraniens, gaz rares. Chacun d’eux est représenté par un symbole. Les éléments chimiques: Tous les corps purs sont formés d'éléments. Un corps simple n'est constitué que d'un élément. Un corps composé contient au moins deux éléments. Un élément est ce qui est commun à un corps simple et à tous ses
composés. Exemples : l'élément oxygène est ce qu'il y a de commun au
"dioxygène" On connaît actuellement plus de 100 éléments chimiques. Chaque élément
possède un nom et un symbole (une ou plusieurs lettres, la première est une
majuscule). (voir tableau ) A un élément correspond un atome. |
|
||||||||||||||||||||||||
|
|
Les atomes: ■Toute substance est formée à partir de très petites particules
appelées : atomes. ■Un atome est la plus petite partie d'un corps simple. ■Chaque atome est composés de : protons, neutrons, électrons,
……. ■ Les protons et les neutrons forment le "noyau" de
l'atome on les appelle
"nucléons". Le nombre de nucléons ( protons
et neutrons) que comporte un noyau est noté « A ».On l’appelle
« nombre de masse » ■Les électrons forment le nuage électronique qui gravite autour
du noyau. Tous les atomes d'un même
élément possède le même numéro atomique et le même nombre de masse. Et ils sont
symbolisés par : ► A et Z sont des
nombres entiers. ► "A" est
appelé "nombre de
masse" (Ce nombre désigne à la
fois le nombre de nucléons, et la
masse d'une mole d'atomes.) ►"Z" est appelé "numéro atomique" -ce nombre désigne le
nombre d'électrons et la place de l'atome dans le tableau des éléments. - Le nombre de protons est égal au nombre de charge
« Z » - Le nombre d’électrons est égal au nombres de protons
puisque l’atome est neutre. ► Le nombre de neutrons est la différence du nombre de masse et du nombre de charge : A - Z Exemple : |
|
||||||||||||||||||||||||
|
|
On retiendra : 1°) un corps pur simple est un assemblage
d’atomes identiques. ( exemple H2 ) 2°) Un corps pur composé
est un assemblage de différents atomes
( exemple H2O ) 3°) Un mélange est un corps hétérogène , il ne possède pas de critères de pureté.(
exemple : du béton) 4°) Une analyse est une
opération qui consiste à séparer les constituants d’un mélange ou corps pur. 5°) Une synthèse est une opération qui consiste à reconstituer
un corps. |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
II) L'atome : le MODELE DE BOHR. |
|
||||||||||||||||||||||||
|
|
L'atome : Autour du noyau gravite des électrons en nombre"Z"
égal au nombre de protons. (voir dans le tableau le nombre "z" )Leur
charge électrique total est "-Z.e". leur nombre augmente à mesure que l'on passe
de l'hydrogène aux atomes lourds. Chaque électron est soumis à une force centripète qui lui impose un
mouvement de rotation autour du noyau. |
|
||||||||||||||||||||||||
|
|
Le mouvement d'un électron n'est pas quelconque, il obéit à certaines
règles. Le nuage électronique est constitué d'un ou plusieurs électrons. Tous
les électrons ne sont pas "retenus" de la même manière par le noyau,
il faut plus ou moins d'énergie pour les séparer du noyau d'où un classement
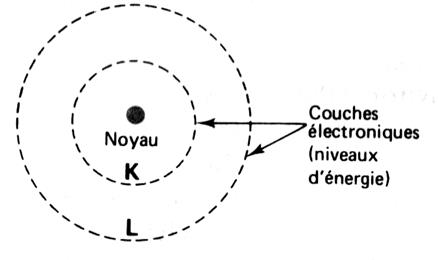
par niveau d'énergie. (dit aussi: couches). Les électrons (
qui forme le nuage électronique) sont répartis sur une ou plusieurs
couches ( dit : niveaux d'énergie). Bohr , en
particulier, a montré l'existence de couches successives qui se remplissent
d'électrons les unes après les autres , en commentant par la plus centrale. |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
INFORMATIONS
sur les couches électroniques: |
|
||||||||||||||||||||||||
|
|
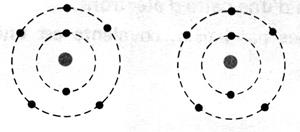
Dans un atome , les électrons se placent sur
les différentes couches 1ère couche avec 2 électrons maximum. 2ème
couche avec 8 électrons au maximum , etc….. Chaque couche appelée « niveau d'énergie » est caractérisé
par une lettre : K, L M …. La première couche est appelée
"couche "K" . Elle peut contenir, au
maximum, deux électrons (ce qui correspond à deux éléments différents : H et He ) La deuxième couche est la couche "L". Elle peut contenir
huit électrons. Au delà,
c'est à dire à partir du dix-huitième électron que la répartition est plus complexe. Les couches peuvent en contenir de plus en plus
qu'elles sont éloignées du noyau. Mais elles se divisent alors en plusieurs
sous- couches. Déjà, en réalité, la couche M peut contenir 18 électrons; c'est sa
première sous couche qui peut en contenir huit. Pour tous les éléments que nous rencontrerons, les couches
électroniques L, M peuvent contenir 8 électrons, seule la première (couche
"K") est saturée à deux électrons. |
|
||||||||||||||||||||||||
|
|
Remarque: On établit
que sur une même couche les électrons se groupent deux par deux pour former
des paires ou "doublet". Lorsqu'un électron isolé n'entre pas dans
la constitution d'une paire, il est appelé "électron célibataire"
ou "singlet". |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
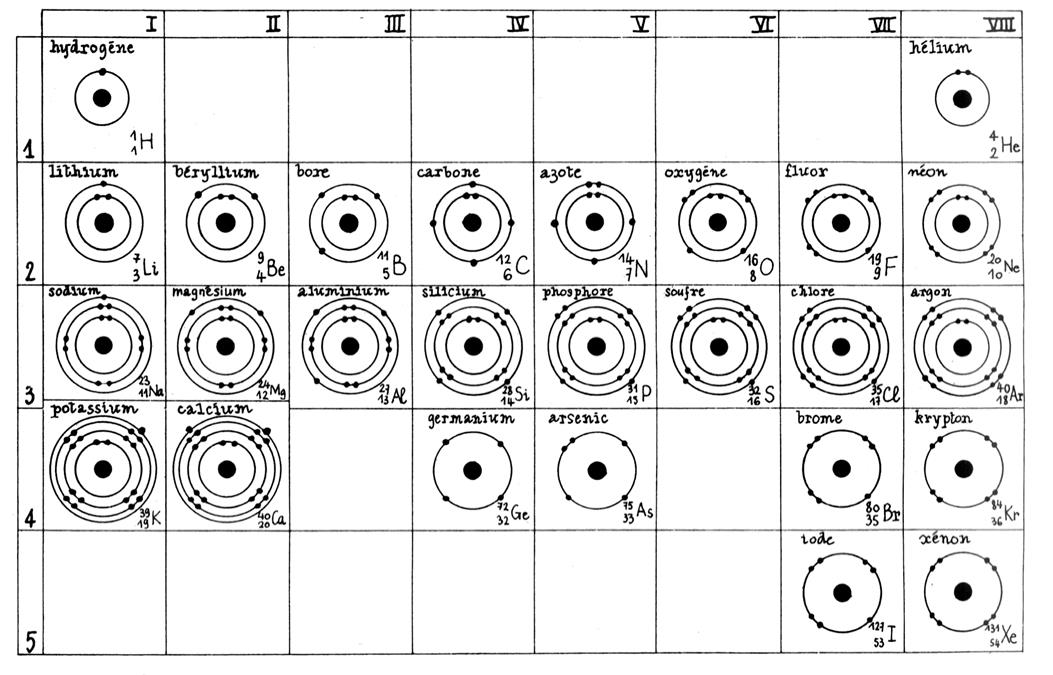
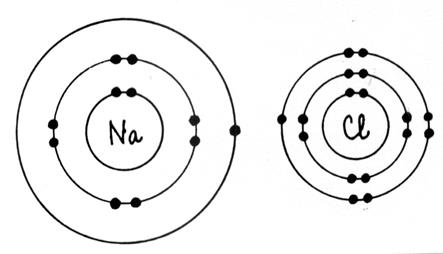
Exemple de répartition des électrons
dans les couches de l’ atome
d’aluminium : Al L’atome d’aluminium
possède 13 électrons (voir
tableau de classification de Mendeleïev) . Ces
électrons se répartissent : K =
2 ; L = 8 ; M = [13 - (2+8)] = 3 ; an conclusion la structure électronique de Al
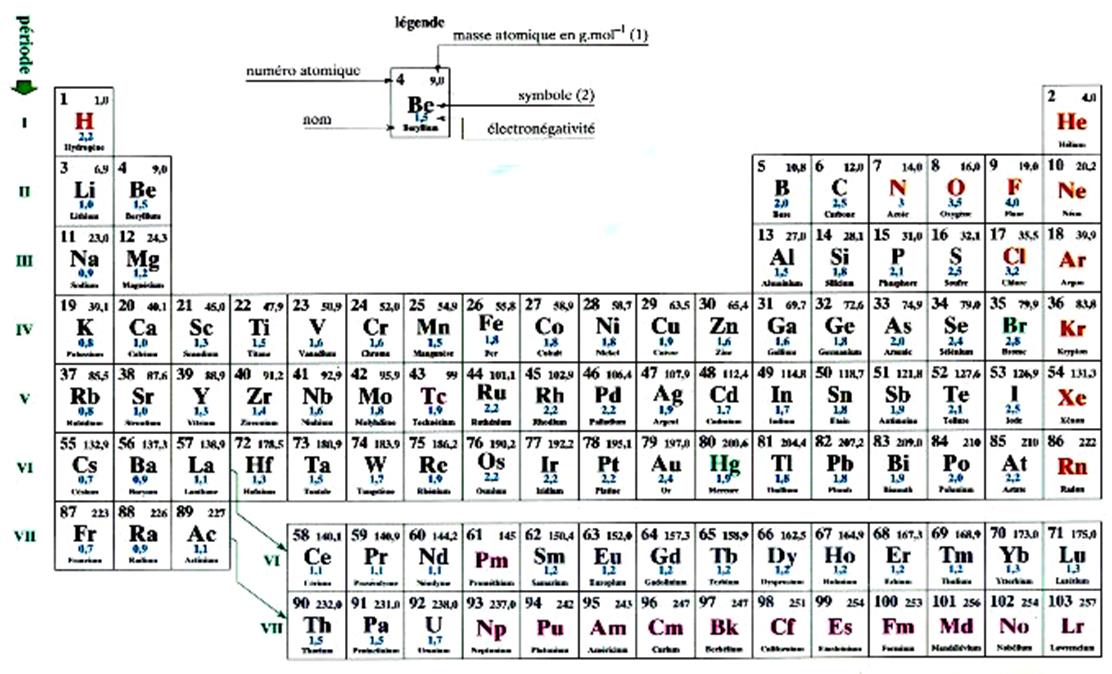
se note (K) 2 (L)8 (M) 3 Extrait du tableau des classifications des éléments chimiques
(représenté avec le modèle de Bohr ) : Premières analyses : le nombre en bas à gauche est appelé
« nombre atomique » Nous constatons que les éléments peuvent être classés par ordre de
nombre atomique croissant. Remarquons qu’au remplissage d’une couche électronique ( niveau d’énergie) correspond à une « période »
(ligne) |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
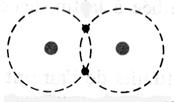
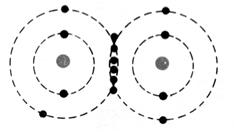
Dans la représentation de Lewis , un point
représente un électron célibataire , et un tiret un doublet électronique. Tous les atomes des éléments d’une même colonne (
sauf l’hélium) ont la même représentation de Lewis. Le nombre d’électrons célibataires nous renseigne sur le nombre de
liaisons possibles de l’atome, qu’on appelle « valence ». Explications : Le modèle de Lewis traduit une
structure électronique externe des atomes :
Rappel : un point représente un électron célibataire
, et un tiret un doublet électronique. Exemple :
Nota : la position du point et du trait ne sont pas soumis à une
position définie. |
|
||||||||||||||||||||||||
|
|
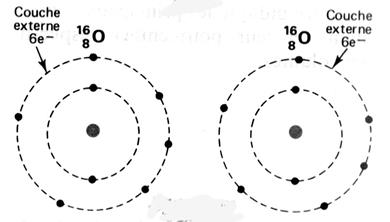
Le tableau ci dessus représente les éléments de la troisième ligne : Na ; Mg ; Al ; Si ;P ;S ;
Cl ; A r . Vous remarquerez que le nombre d’électrons de la couche externe croît
respectivement de Un à huit. Représentation de la molécule de chlore :
Question : Combien chaque atome de chlore a- t- il d’électrons
périphériques en considérant que les deux électrons de liaison appartiennent
aux deux atomes à la fois ? (réponse : on considère que les électrons de la liaison
appartiennent aussi bien à un atome de chlore qu’à l’autre atome, car ils
sont mis en commun ; chaque atome de chlore a donc, lorsqu’il est lié à
un autre atome, 8 électrons sur sa couche électronique externe.) Donner la représentation de Lewis
de la molécule de chlorure d’hydrogène HCl ?
Petit rappel historique : depuis longtemps, les
chimistes ont cherché à ordonner leurs
connaissances, et à classer les éléments de manière logique. De
nombreux essais de classification furent proposés sans grand succès par
différents auteurs. En 1869, le chimiste russe Dimitri Mendeleïev établit la classification périodique des éléments . Complétée par la suite ,
elle se révèle de nos jours un instrument de travail remarquable . L’idée de
base est due à une observation : en rangeant les éléments dans l’ordre
des masses atomiques croissantes, une certaine périodicité se retrouve dans les propriétés. Classification périodique actuelle des éléments. La classification des éléments par Mendeleïev, basée sur
l’observation, trouve de nos jours des assises particulièrement solides dans
la structure des atomes .Nous utiliserons un tableau à huit colonnes et nous
disposerons les éléments dans l’ordre croissant de leur numéro atomique (et
non de leur masse). A chaque ligne du tableau correspond le remplissage d’une
couche électronique. Ainsi, par exception, la première ligne ne referme que deux éléments :
l ’ hydrogène
et l ’ hélium ( Z = 1 et Z = 2 ) . On les dispose, l’un à la première
case, l’autre à la dernière. Les autres lignes renferment un élément dans chaque colonne : il
y a huit colonnes, parce que chaque couche électronique peut contenir huit
électrons .La deuxième ligne renferme tous les éléments dont le numéro
atomique varie depuis Z = 3 jusqu ’ à Z = 10,
la troisième ligne, tous les éléments depuis Z = 11 jusqu
‘ à Z = 18 ; et ainsi de suite ….. Au delà du
dix - huitième élément , le remplissage des couches
est plus complexe , et cela se traduit
par un nombre de colonnes supérieur à huit . Dans ce cours nous limitons l ’ étude des
éléments à ceux dont les couches
électroniques renferment huit électrons . De même ,
nous limitons le tableau périodique à
huit colonnes ( les trois premières lignes)
. Il est utile de connaître la place de quelques éléments que nous
rencontrons assez souvent. Notamment : H , C , N , O , F , Na ,
Mg , Al , S , Cl , K , Ca , Br Dans la classification périodique , les
éléments sont classés par numéro atomique « Z » croissant. |
|
||||||||||||||||||||||||
|
|
Voici le début de la classification :
|
|
||||||||||||||||||||||||
|
|
Chaque ligne (appelée période) correspond au remplissage progressif
d’une couche électronique. -première ligne : remplissage de la couche « K » ; - deuxième ligne : remplissage de la couche
« L » ; - troisième ligne : remplissage partiel de la couche
« M ». Les éléments dont les atomes ont le même nombre d’électrons sur la
couche externe ( sauf l’hélium)figurent dans une
même colonne. Ces éléments constituent une famille. Ils ont des propriétés
chimiques semblables. Voir tableau ci - dessous : |
|
||||||||||||||||||||||||
|
|
Structure du cortège électronique |
|
||||||||||||||||||||||||
|
|
Tous les électrons d’un
atome sont « accrochés » à son noyau ;
pour arracher un électron de son noyau , faut
fournir une « certaine » quantité d’énergie . Nous savons que les électrons d’un atome sont répartis en « couches ». La quantité d’énergie à fournir pour « extraire » un
électron est fonction de son appartenance à la couche à laquelle il
appartient. Ainsi pour arracher chaque électron d’une même couche
, il faut fournir la même énergie. On dit que les électrons d’une
couche ont le même niveau d’énergie. On retiendra que : les électrons se r^partissent
en « niveaux d’énergie » (couches) . Les
niveaux d’énergie (ou couches) sont
désigné par les lettres K , L M , O |
|
||||||||||||||||||||||||
|
|
Remplissage des couches. |
|
||||||||||||||||||||||||
|
|
Principe : -
Les électrons occupent d’abord la
« première » couche « K » ,(
cette couche ne peut contenir au plus 2 électrons), -
Remarque : quand la couche atteint sa capacité
maximale on dit qu’elle est « saturée ». -
Lorsque la couche « K » est saturée , les électrons restant vont se placer sur
la couche L , à concurrence de 8 électrons ( capacité maximale de la couche
L). -
Lorsque la couche « L » est saturée :
les électrons restant vont ensuite remplir la couche « M » qui elle
se saturera à 8 électrons ; … Au delà,
c’est à dire à partir du dix- huitième
électrons , la répartition est plus complexe. Les
couches peuvent en contenir de plus en plus à mesure qu’elles sont éloignées
du noyau. Elles se divisent alors en sous couches. |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
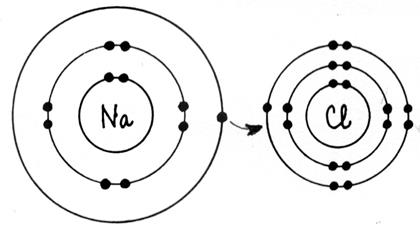
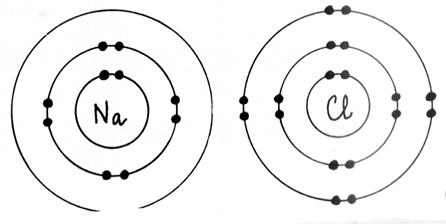
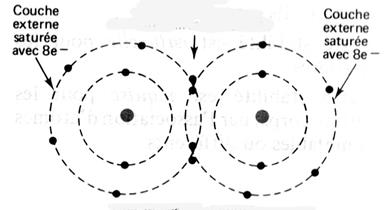
►Règle de l’octet Au cours des réactions
chimiques, les atomes tendent à acquérir la structure électronique du gaz
rare de numéro atomique le plus proche, avec huit électrons sur la couche
externe. Cette règle comporte des exceptions. C’est par exemple le cas de
l’hydrogène qui tend à compléter sa
couche à deux électrons ( structure de l’ hélium) . ►Les atomes forment des ions et des molécules en respectant , en général , la règle de l’octet. Les atomes de la première couche ( nommés :
les alcalins) donnent des ions comportant une seule charge élémentaire
positive ( exemple Na+ ) Les atomes de la deuxième couche ( les alcalino - terreux ) donnent des ions comportant deux
charges élémentaires positives ( exemple Mg 2+ ) Les atomes de l’avant dernière colonne ( les
halogènes) ont tendances à donner des
ions comportant une seule charge élémentaire négative ( Cl- ) ► Dans les molécules, les atomes sont liés par des liaisons de
« covalence ». Une liaison de covalence correspond à la mise en commun de deux
électrons entre deux atomes. On la représente par un trait ( exemple H -- H ) |
|
||||||||||||||||||||||||
|
|
Etude de
la classification périodique des éléments : |
|
||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
Les relations entre la structure atomique et la classification des élément apparaissent nettement (voir tableau) On peut presque dire que Mendeleïev avait prévu cette structure
électronique. Il ignorait pourtant tout des
électrons, mais il supposa, avec raison, que la périodicité dans les
propriétés avait une origine dans la structure de l’atome. a)
Dans une même colonne, tous les atomes possèdent
le même nombre d ‘ électrons dans la dernière couche .Ce nombre est le numéro
de la colonne. b)
L’expérience montre que les éléments d’une même
colonne possèdent des propriétés voisines, sinon semblables. c)
En outre, on constate que la dernière colonne,
celles qui ont toutes les couches
contenant des électrons saturées, cette colonne est celle des gaz rares.
Or ces derniers ont une inertie
chimique remarquable : pratiquement, ils ne donnent aucune combinaison
avec un autre atome. Cela signifie que leur structure, où toutes les couches électroniques sont saturées, est
particulièrement stable. Remarque : Pour tenir compte de ces fait , on a groupé les éléments par
familles , formant des ensembles homogènes : famille des métaux alcalins
( première colonne ) , famille des métaux alcalins terreux ( deuxième colonne
) , famille des halogènes ( septième colonne) , famille des gaz rares ( huitièmes colonne) Conclusion :
Un rapprochement de ces conclusion permet d’admettre que : 1.
L’essentiel des propriétés chimiques des atomes
dépend des électrons de la dernière couche. 2.
Plus spécialement du nombre d’électrons qu ‘elle renferme. 3.
La stabilité chimique maximale est obtenue
lorsque toutes les couches contenant des électrons sont saturées. (Faire un rappel sur les ions). |
|
||||||||||||||||||||||||
|
|
VOCABULAIRE
de base utilisé en CHIMIE |
|
||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
Le vocabulaire utilisé en chimie pour désigner un produit chimique doit permettre,
lorsqu'il s'agit d'un corps composé : - de
connaître la nature des éléments présents dans ce corps. - De
prévoir la formule chimique de ce
corps. Réciproquement la connaissance d'une formule permet, dans les cas
simples, de donner le nom chimique du
produit. Oxyde : un oxyde est un corps pur composé qui contient l'élément
"oxygène" (O) Exemples: Cu O :
oxyde de cuivre MgO : oxyde de oxyde Sulfure : un sulfate est un corps pur composé qui contient l'élément
"soufre" (S) Exemples : FeS :
sulfure de fer H2 S sulfure
d'hydrogène Chlorure: un chlorure est un corps pur
composé qui contient du "chlore"
(cl) Exemples : AgCl chlorure d'argent FeCl2 chlorure de
fer Hydroxyde : un hydroxyde est un corps pur composé qui contient le groupement d' oxygène et hydrogène (OH) Exemple : Fe (OH)2 l'hydroxyde de fer KOH est la formule de
l'Hydroxyde de potassium. Carbonate : un carbonate est un corps pur composé qui contient le
groupement de un atone de carbone et 3
atomes d'oxygène ,
noté CO3 Exemples : Formule : CaCO3 est
appelé "carbonate de calcium". ZnCO3 est la formule du carbonate de zinc . Nitrate : un nitrate est un corps pur composé qui contient le groupement d'un atome d'azote (N) et 3 atomes d'oxygène (O3). Noté :
NO3 Exemples : Formule : AgNO3 est appelée "nitrate d'argent" Formule Pb(NO3)2 est appelée "nitrate de plomb". Sulfate : un sulfate est un corps pur
composé qui contient le groupement d'un atome de soufre et 4 atomes
d'oxygène ; noté : SO4 Exemples: Formule CuSO4 est appelée
"sulfate de cuivre" ;( utilisé pour traiter les
mousses) Formule ZnSO4 est appelée "sulfate de zinc" . |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
:
Travaux auto
formatifs
CONTROLE:
Premier contrôle : semaine 1
1°) Combien y a t- il de catégories de corps dans la nature , nommer les ?
2°) Donner la définition d’un mélange .
3°) Donner la définition d’une combinaison.
4°) Qu’est ce qu’un corps pur simple ?
5°) Qu’est ce qu’un corps pur composé ?
6°) Nommer les sept corps purs
composés de base.
7°) Donner la combinaison de chaque : CO3 , NO3 ,
Deuxième contrôle : semaine 2
1°) définir un : Oxyde : Sulfure ; Chlorure ; Hydroxyde
; Carbonate ; Nitrate ; Sulfate
1°) Que désigne les composés suivants :
A faire sans le contrôle :
identifier les Oxyde ; Sulfure ;
Chlorure ; Hydroxyde ; Carbonate ; Nitrate ; Sulfate ; dans les
formules suivantes :
CaCO3 ; ZnCO3
;
AgCl
; FeCl2 FeS H2 S ; CuSO4 ; ZnSO4 ;AgNO3 ;Pb(NO3)2 ; Fe (OH)2 ; KOH
; Cu O ; MgO
Devoirs : Classification
des éléments
|
|
Questions : |
|
|
1.
|
Classer les éléments
|
|
|
2.
|
Combien y - a - t- il d’éléments entre le
béryllium et le carbone ? |
|
|
3.
|
L’ atome
d’oxygène a deux électrons sur la couche « K » et six sur la couche
« L » ; Dans quelle ligne l’élément oxygène se trouve - t -
il ? |
|
|
4.
|
Une période dans la classification périodique correspond
- elle à une ligne ou une colonne ? |
|
|
5.
|
Quelle particularité électronique, les atomes des éléments d’une même
famille présentent -ils ? |
|
|
6.
|
Les atomes de fluor et de néon ont respectivement 7 et 8 électrons sur
la couche L ( qui est complète à 8 électrons) L’un de ces atomes correspond à un gaz inerte ,
lequel ? |
|
|
7.
|
Quel est l’ion correspondant à l’autre atome ? |
|
|
8.
|
On représente la molécule de di chlore par le schéma Cl--Cl |
|
|
9.
|
- combien
cette molécules comporte - t - elle d’atomes ? |
|
|
10.
|
- Quelle
est la nature de la liaison chimique ? |
|
|
11.
|
- Combien d’électrons sont
-ils mis en commun ? |
|