EXERCICE D'ATOMISTIQUE
Exercice
n°1
1°) Déterminer les nombres de protons, de
neutrons, et d'électrons contenus dans les atomes dont le symbole est le
suivant :
![]()
2°)
Pour chaque atome, calculer la masse du noyau.
Données : Masse
d'un neutron : 1,672´10-27Kg
Masse
d'un proton : 1,672–10-27 Kg
Exercice n°2
Les atomes suivant sont représentés par leurs
symbole :
![]()
1°) Ces atomes représentent t-ils le même élément ?
2°) Comment appelle t-on ces atomes ?
3°) Pour chaque atome, donner la composition du
noyau.
Exercice n°3
L'atome de sodium (Na) et l'atome de magnésium se
transforment facilement en ions positifs :
![]() et
et ![]()
1°) Pour chaque atome et chaque ion ci-dessus donner
la configuration électronique.
2°) Donner la représentation de Lewis de chaque
atome et ion.
Exercice n°4
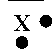
Un atome X a pour représentation de Lewis :
1°) Donner le nombre d'électron de sa couche
externe.
2°) Sachant que cette couche est la couche M,
trouver le n° atomique de cet élément.
3°) Donner son nom et son symbole.
Exercice n°5
L'ion X porte une charge négative et possède 8
électrons sur sa couche M qui est sa couche externe.
1°) Calculer le nombre d'électrons qu'il possède.
2°) En déduire le nombre d'électrons de l'atome
correspondant, son nom et son symbole.
3°) Mêmes questions que ci-dessus si l'ion X porte 3
charges négatives et possède 8 électron sur sa couche externe L.
