TRAVAUX PRATIQUES DE CHIMIE
IDENTIFICATION DES IONS EN SOLUTION
+But des manipulations : Réaliser
et observer des réactions chimiques faisant intervenir une solution contenant
un ion à identifier et une solution contenant le réactif testeur.
+Principe : Les réactions
d'identification des ions en solution sont basées sur l'observation d'un
précipité ( composé solide qui se forme dans la solution ) ou d'un changement
de couleur intervenant dans la solution à tester lorsqu'on ajoute le réactif
testeur.
Si on observe quelque chose, le test est positif sinon il
est négatif.
+Protocole à suivre pour tous les tests
Sur la paillasse sont disposés plusieurs béchers contenant
les solutions contenant les ions à tester ainsi que trois béchers contenant les
solutions avec le réactif testeur. A chaque bécher est affecté une pipette en plastique à prendre pour le
prélèvement !!!!
¶ Prélever à l'aide
d'une pipette plastique propre quelques millilitres de solution
contenant l'ion à tester.
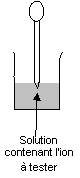
· Verser ce prélèvement dans
un tube à essai propre.
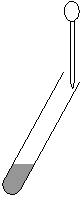
¸ Prélever à l'aide d'une pipette
plastique propre quelques mL de la solution contenant le réactif testeur.



¹ Verser quelques gouttes de ce prélèvement
dans le tube à essai. Observer le résultat.
i Utiliser toujours la même
pipette avec la même solution
º Compléter le tableau
récapitulatif de la page suivante.
» A la fin des tests
nettoyer tous les tubes à essai à l'évier et les rincer à l'eau distillée,
+Travail à réaliser
Pour toutes les réactions précédentes, en vous aidant des
données ci-dessous, écrire l'équation bilan de chaque réaction.
|
Réactifs
|
Produits
|
Equation bilan
|
|
Fe2+/OH-
|
Fe(OH)2
|
|
|
Fe3+/OH-
|
Fe(OH)3
|
|
|
Cu2+/OH-
|
Cu(OH)2
|
|
|
Cl-/Ag+
|
AgCl
|
|
|
Zn2+/OH-
|
Zn(OH)2
|
|
|
Ag+/Cl-
|
AgCl
|
|
|
SO42-/Ba2+
|
BaSO4
|
|
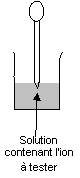

![]()
![]()
![]()

![]()
![]()
![]()
