Devoir de Sciences n°2
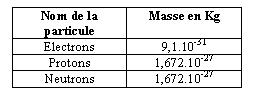
Données :
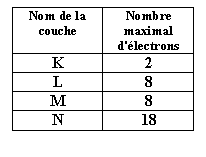
Exercice n°1
Donnez la structure électronique des atomes suivant : ![]()
![]()
![]()
![]()
![]()
Exercice n°2
1°) Donnez la répartition des électrons dans les différentes couches des atomes précédents.
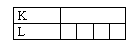
![]() :
: ![]()
![]()
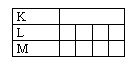


![]()
![]()
![]()
2°) En déduire la structure de Lewis de chacun de ces atomes
3°) Donner la formule développée de La molécule CO2
4°) Donner la formule développée de la molécule CH2OH.
5°) Donner la formule développée de la molécule H2S.
Exercice n°3
Calculez la masse molaire ( en g/mol) arrondie au dixième ) de l'atome de carbone sachant qu'une mole d'atome de carbone contient 6,023.1023 atomes de carbone.
(
Indication : calculez d'abord
la masse d'un atome de carbone à partir de la masse des particules qui le
constitue, puis déduisez-en la masse d'une mole.)
Exercice n°4
1°) Qu'est-ce qu'un anion ?
2°) Qu'est-ce qu'un cation ?
3°) Quel est l'ion formé par un atome de Calcium (Ca) qui perd 2 électrons ?
4°) Quel est l'ion formé par un atome de fluor (F) qui gagne 1 électron ?
5°) Quel est l'ion formé par un atome de potassium (K) qui perd 1 électron ?