HISTOIRE DE L'ATOME
De sa belle ville sicilienne d'Agrigente, le Grec
Empédocle (vers 492-432 av. J.-C.) divisa la matière en quatre éléments, qu'il
appela aussi "racines":
l'eau la terre l'air le feu
Ces éléments sont mus par les forces de l'amour et
de la haine.
Dans l'amour absolu, ils forment une unité
homogène, alors que la haine les sépare. Lorsque ces deux forces entrent en
conflit, le mélange des éléments fait surgir les choses matérielles.
Cette vision de la matière préfigure déjà un peu la nôtre par la notion d'éléments liés par des forces
attractives et répulsives.
+
LES GRECS ATOMISTES
Le mot "atome" vient du grec "a-tomos" et signifie "insécable". Cette
notion fut inventée par Leucippe de Milet en 420 avant J.C.
Son
disciple, Démocrite d'Abdère (vers 460-370 av. J.-C.), expliquait que la
matière était constituée de corpuscules en perpétuel mouvement et dotés de
qualités idéales; Ces corpuscules étaient:
·
invisibles à cause de leur extrême
petitesse
·
insécables ou indivisibles comme leur nom
l'indique
·
pleins (pas de vide à l'intérieur)
·
éternels car parfaits
·
entourés d'un espace vide (pour expliquer
le mouvement et les changements de densité)
·
ayant une infinité de formes (pour expliquer
la diversité observée dans la nature)
L'atome est-il d'origine grecque ?
Il semble qu'à la même époque que celle de
Leucippe, il existait en Inde une philosophie (système Vaiseshika)
qui enseignait déjà que la matière était formée d'atomes indestructibles: Leur
assemblage en choses visibles est dégradable et, au terme d'une période du
monde, les liaisons atomiques se dissolvent, puis après une phase de repos, se
réunissent en un nouveau monde... Donc pas de monopole atomiste grec...
La doctrine atomiste grecque sombra dans l'oubli
pendant de longs siècles et laissa place au triomphe durable de la théorie des
quatre éléments d'Empédocle.
+L'ALCHIMIE
DU MOYEN-AGE
Née au Moyen-Age,
l'alchimie est née des progrès de la métallurgie et de l'insuffisance de la
théorie des 4 éléments à représenter la diversité de la matière.
Le grand dessein de l'alchimie était d'obtenir la
transmutation des métaux "vils" (tels que le cuivre) en métaux
"nobles" tels que l'or. Sans doute parce que le succès du "Grand
Oeuvre" (la transmutation) ouvrait des perspectives de richesse et de
pouvoir, l'activité des alchimistes s'entourait de secret et s'inscrivait dans
une démarche très ancienne d'ésotérisme et d'occultisme.
La démarche de l'alchimie (comme celle de
l'astrologie d'ailleurs) établissait des liens symboliques qui unissaient le
microcosme au macrocosme (monde des planètes). Par exemple, l'élément Plomb
était associé à la planète Saturne car celle-ci nous apparaît d'une couleur
jaune "plombée".
Malgré leur croyance ésotérique, les alchimistes
développèrent l'observation, l'expérimentation, la mesure et la classification
des éléments: l'alchimie est donc un précurseur respectable de la chimie.
D'ailleurs n'oublions pas que Newton en fut adepte et que la physique actuelle
a réalisé le vieux rêve de la transmutation en transformant certains atomes en
d'autres.
+
LE TABLEAU DE MENDELEIEV
En 1869, le chimiste russe Dimitri Mendeleïev
construit un tableau qui classe tous les éléments chimiques alors connus
d'après leurs propriétés chimiques. Ce tableau servira plus tard à classer
méthodiquement tous les atomes naturels et artificiels d'après leur numéro
atomique (c'est-à-dire le nombre de leurs protons).
+DECOUVERTE
DE L'ELECTRON
Et, en 1897, Thompson découvre le premier
composant de l'atome: l'électron, particule de charge électrique négative.
En 1904, il propose un premier modèle d'atome,
surnommé depuis "le pudding de Thompson".
Il imagine l'atome comme une sphère remplie d'une sustance électriquement positive et fourrée d'électrons
négatifs "comme des raisins dans un cake".
+DECOUVERTE
DU NOYAU
En 1912, Rutherford
(physicien néo-zélandais) découvre le noyau atomique.
Son nouveau modèle d'atome montre que sa charge
électrique positive, ainsi que l'essentiel de sa masse, est concentrée en un
noyau quasi-ponctuel.
Les électrons de l'atome se déplacent autour de ce
noyau tels des planètes autour du Soleil, et la force électrique attractive (la
charge - de l'électron attirant la charge + du noyau) joue le rôle de la force
de gravitation pour les planètes; d'où le nom de modèle d'atome planétaire.
A noter que contrairement à l'atome des Grecs,
celui de Rutherford n'est ni indivisible (puisque
composite), ni plein puisqu'il contient essentiellement du vide: La distance noyau-électrons est 100.000 fois plus grande que le
diamètre du noyau lui même (diamètre du noyau = 10-
+
DECOUVERTE DES NUCLEONS
Rutherford
comprend que le noyau est lui-même composé de nucléons. Ces nucléons sont de
deux sortes:
· de charge positive, c'est un proton.
· de charge neutre, c'est un neutron
Le neutron sera effectivement découvert en 1932
par Chadwick.
Le modèle planétaire de l'atome présente un gros
défaut. Les électrons peuvent émettre de la lumière sous certaines conditions
(dans un ampoule électrique par exemple); ce faisant, ils perdent de l'énergie
et devraient donc se rapprocher dangereusement du noyau jusqu'à s'y écraser!
Un tel atome ne serait donc pas stable.
+
L'ATOME DE BOHR
Afin de rendre compte de cette stabilité atomique,
Niels Bohr crée en 1913 un nouveau modèle d'atome:
Les orbites des électrons ne sont pas quelconques
mais "quantifiées"; seules certaines orbites particulières sont
permises pour l'électron. Ce n'est que lorsque celui-ci saute d'une orbite à
l'autre qu'il peut émettre (ou absorber) de la lumière.
+VERS
Le modèle de Bohr est le dernier modèle obéissant
à la physique classique, c'est-à-dire la physique qui explique les mouvements
et les phénomènes existant à notre échelle humaine. Ces modèles d'atomes sont
donc faciles à comprendre et à se représenter.
Quel plaisir intellectuel (et quelle paresse!) que
de se représenter les atomes sous forme de petites boules tournant les unes
autour des autres...
Ce modèle est d'ailleurs toujours celui que le
grand public affectionne!
Eh bien ce modèle est faux car, à l'échelle
atomique, de nouvelles lois s'appliquent! Ces lois appartiennent à une étrange
physique très éloignée de nos concepts habituels: la physique quantique.
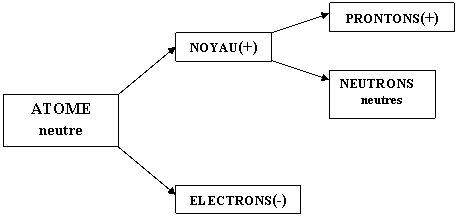
STRUCTURE DE L'ATOME
L'atome est le constituant fondamental de la
matière.
Un corps constitué d'atomes de même espèce est
appelé corps simple
Structure
interne de l'atome
Un chimiste Russe est l'un des
fondateur de la chimie pour ses travaux sur les atomes :
Dimitri
Mendeleïev (1834-1907)
Il
classe en 1869 les éléments en fonction de leur poids atomique («classification
périodique des éléments») et démontre que leurs propriétés chimiques sont des
fonctions périodiques de ce poids atomique, ce qui révolutionne la chimie en
général.

L'atome étant neutre contient autant de charges
positive que négative donc l'atome aura donc autant de………………que de…………………...
Les protons et les neutrons s'appellent :
les……………………..
Représentation
d'un atome
Un atome est représenté par un symbole :
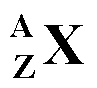
![]()
Pour
les atomes suivants donnez le nombre de masse A et le numéro atomique ainsi que
le nombre d'électrons, le nombre de protons et le nombre de neutrons :
|
Atome |
Nombre de masse A |
Numéro atomique Z |
Nombre d'électrons |
Nombre de protons |
Nombre de neutrons |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Les différents niveaux d'énergie des électrons
Les électrons qui gravitent autour du noyau se
répartissent en couche ( ou niveaux d'énergie).
Les
couches sont désignées par les lettres K, L, M, N, O, P, Q.
Chaque
couche peut contenir un nombre maximal d'électrons regroupé dans le tableau
suivant :
|
Nom de la couche |
Nombre maximal d'électrons |
|
K |
2 |
|
L |
8 |
|
M |
8 |
|
N |
18 |
|
O |
18 |
|
P |
32 |
|
Q |
18 |
Les électrons remplissent d'abord la couche K puis
Donnez
la structure électronique des atomes suivant en complétant le tableau suivant :
|
Atome |
Numéro atomique Z |
Nombre d'électrons |
Structure électronique |
Remplissage des couches |
|||||||
|
|
|
|
(
K
) |
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
|
|
|
(
K
) ( L ) |
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
|
|
|
|||||||
|
M |
|
|
|
|
|||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
||||||||||
|
M |
|
||||||||||
|
N |
|
||||||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
||||||||||
|
M |
|
||||||||||
|
|
|
|
|
K |
|
||||||
|
L |
|
||||||||||
|
M |
|
||||||||||
Représentation
de Lewis d'un atome
Seuls les électrons de la dernière couche
électronique figurent dans la représentation de Lewis d'un atome.
Une paire d'électrons est représentée par un
trait.
Un électron seul est appelé électron célibataire.
|
Atome |
Remplissage de la dernière couche |
Représentation de Lewis |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Les
isotopes
Les atomes ayant le même numéro atomique Z mais un nombre de masse A différents sont
appelés isotopes :
Exemple : ![]() : hydrogène
: hydrogène ![]()
![]() :
:
![]() :
: ![]() :
: ![]() :
:
La
classification périodique des éléments
Elle regroupe les atomes ( ou
éléments ) suivant leur numéro atomique Z croissant.
Chaque ligne correspond à un remplissage d'une
nouvelle couche.
Les atomes appartenant à la même colonne ont la
même structure électronique externe : ils ont donc la même représentation de
Lewis.
Il existe différentes familles d'éléments :
Première
colonne :
Alcalins ( à l'exception de
l'hydrogène ) : Li, Na, K….
Septième
colonne :
Les halogènes : F, Cl, Br ……
Huitième
colonne : Les gaz
Nobles : He, Ne, Ar……
La seconde information donnée importante est la
masse molaire de l'élément.
La masse molaire M d'un élément X correspond à la
masse de 6,023 ´
1023 atomes de cet élément.
Elle est exprimée en gramme par mole : (g/mol ou g
mol-1)
|
Particules |
Masse(Kg) |
|
Electron |
9,1
´ 10-31 |
|
Neutron |
1,672
´ 10-27 |
|
Proton |
1,672
´ 10-27 |
Calculez la masse d'une mole
D'hydrogène
:
De carbone :
D'azote :
IONS ET MOLECULES
 La
règle de l'octet
La
règle de l'octet
Les atomes peuvent alors :
-
gagner ou perdre des électrons et se transformer
en ions ( cations(+), anions(-) )
-
former des liaisons de covalence par la
mise en commun d'électrons célibataires pour former des liaisons de covalence
Formation
d'ions
|
Atome |
Nom et structure électronique du gaz
noble le plus proche |
Ion formé par l'atome |
|
Cl |
|
|
|
Mg |
|
|
|
K |
|
|
|
Na |
|
|
Ces ions formés sont monoatomiques.
Il existe aussi des ions polyatomiques
: SO42- : ion…………….
OH- :
ion…………….
H3O+ : ion…………….
HCO3-
:ion…………….
Formation
de molécules
En vous aidant de la règle de l'octet et des
modèles moléculaires quelles molécules peut-on former à partir des atomes que
l'on vous donne.
1 atome de carbone et 2 atomes d'oxygène
Représentation de
Lewis de C :
Représentation de
Lewis de O :
Formule développée : Formule brute :
(
représentation de Lewis
)
1 atome d'oxygène et 2 atomes d'hydrogène
Représentation de
Lewis de O :
Représentation de
Lewis de H :
Formule développée : Formule brute :
(
représentation de Lewis
)
1 atome d'azote et 3 atomes d'hydrogène
Représentation de
Lewis de N :
Représentation de
Lewis de H :
Formule développée : Formule brute :
(
représentation de Lewis
)
Exercices
1°) Donnez le nom et le nombre d'atomes des
éléments qui forment les molécules suivantes :
Dihydrogène
: H2 Eau : H2O Chlorure de cuivre II : CuCl2
Acide sulfurique : H2SO4 Sulfate d'aluminium
: Al2(SO4)3
Carbonate de calcium : CaCO3

2°)
Donnez le nom et le nombre d'atomes des éléments qui forment les molécules
suivantes :
3°) Ecrivez les formules développées des molécules
ci-dessous :
Fluorure d'hydrogène : HF Chlorure d'hydrogène : HCl
Dioxyde de carbone : CO2 Cyanure d'hydrogène : HCN
Ion hydroxyde :
OH- Ion
hydronium : H3O+
4°) Calculez la masse molaire des molécules
suivantes :
H2O
:
CO2
:
C2H6
:
CH3SH
:
C10H20O
:
C12H25SO3Na :
LES REACTIONS D'OXYDOREDUCTION
Expérience n°1 Réaction entre un
métal et une solution ionique
Matériel
: - deux tubes à essai
- du
sulfate de cuivre
- de
la poudre de fer
- de
l'eau
1°) Observez de la poudre de sulfate de cuivre.
Couleur de la poudre :
…………………
Formule chimique du
sulfate de cuivre : ………………
2°) Prenez un tube à essai rempli pour moitié avec
de l'eau et ajoutez-y du sulfate de cuivre.
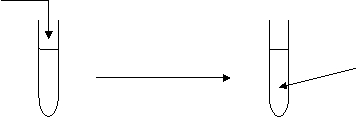
Compléter le schéma
Que
constatez vous ? ………………………………………..

![]()
Ceci est une réaction de……………….
3°) Prenez le tube
à essai contenant la poudre de fer, ajoutez-y la solution de sulfate de
cuivre. Boucher le tube et agitez légèrement, débouchez ensuite.
Compléter
le schéma

Que
constatez-vous ?……………………………………………..
Complétez l'équation bilan ci-dessous :
introduire les couples
4°) Regardez ce qui se passe lorsqu'on ajoute
quelques gouttes de soude à une solution de sulfate de fer :
![]()
En
solution : FeSO4 ………+……….
![]()
En
solution : NaOH …….
+ ………..
![]()
En
présence d'ion Fer II (…..) Fe…. +
…..OH- …………
C'est
une réaction de …………………..
5°) Ajouter quelques gouttes d'une solution de
soude dans votre tube à essai.
Que
constatez- vous ?…………………………………
Qu'en
concluez-vous ?……………………………
Compléter la réaction :

Conclusion
:
Les deux réactions ayant eu lieu lors de l'ajout
de la solution de sulfate de cuivre (………..) sur la poudre de fer sont :
……………………………….
![]()
……………………………….
![]()
Equation
bilan générale : …… + …….. ……..+………
C'est
une réaction…………………
Conclusion
On vient donc de réaliser une réaction d'oxydo-réduction dans laquelle les deux couples mis en
présence sont…………………et………………….
On dit que l'ion…………a………………..le fer ou que le fer
a…………….l'ion…….
UTILISATION DES REACTIONS D'OXYDO-REDUCTION
1°)
Fabrication d'une pile
Schéma
de l'expérience :
Observation
:
Interprétation
:
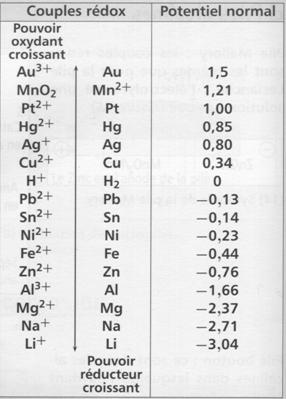
2°)
Classement des couples rédox
1. On réalise les 4 demi piles suivantes :
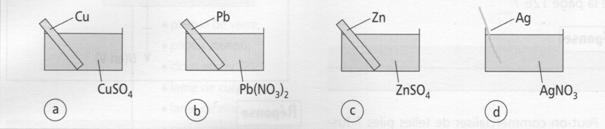
2. Nommez les couples rédox
mis en présence dans chacun des béchers
Une fois réalisée mesurez la tension aux bornes de
la pile en reliant la borne COM du voltmètre à la lame de plomb et la borne +
du voltmètre à la lame de cuivre.
Schéma
de l'expérience :
Résultat
de la mesure :
En déduire la nature des réactions mise en jeu à
chaque pôle
Pôle
+ : Couple………. Pôle - : Couple………
Réaction
:…………………………………….. Réaction : ……………………………...
Nature
de la réaction : Nature
de la réaction :
4. Faîtes de même en remplaçant la demi pile Pb2+/Pb
par les autres demi-piles et reprotez
la valeur de la tension lue dans le tableau :
|
Demi-pile
Zn2+/Zn |
Tension lue : |
|
Demi-pile
Ag+/Ag |
Tension lue : |
5. Le cuivre est-il toujours le pôle + de la pile ?
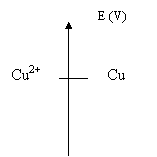
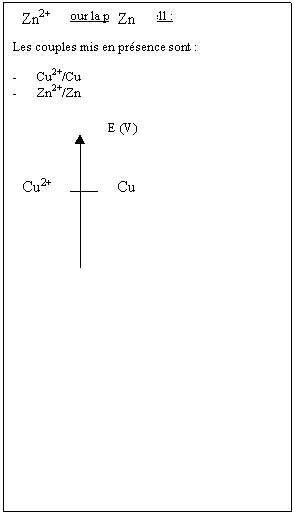
6.Placez les potentiels des
couples redox sur l'axe ci-dessous en utilisant les valeurs des tensions que
vous avez relevées .
Conclusion :
A chaque couple rédox est
associé un potentiel normal
d'oxydoréduction exprimé en volt (V).